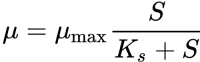Tabela de conteúdos
Crescimento Microbiano
Ter o conhecimento do que é o fator de crescimento microbiano, seus mecanismos de proliferação e os elementos que corroboram, podem ajudar em diversas ocasiões, como por exemplo, conhecendo como funciona e suas características, podemos controlar o crescimento microbiano, que ocorre em casos de doenças, biodeteriorização de alimentos, entre outros. É possível também promover o crescimento em culturas para identificar patógenos responsável por infecção, ou até mesmo favorecer microrganismo que são benéficos, como os que residem a microbiota intestinal.
Quando colocado o tema crescimento microbiano, é necessário explicitar que é referente ao aumento do número de microrganismo, ou seja o aumento de número de células da população, pois pode ser confundido em relação ao aumento do tamanho celular.
Explicando brevemente, a multiplicação dos microrganismos se dá por fissão binária ou gemulação, em resultado a célula originará duas outras, ao fim de um certo tempo, denominado “tempo de duplicação”. A fase de crescimento da população celular, pode ser encontrada duas taxas a de crescimento equilibrado e a fase de crescimento exponencial.
Divisão Celular
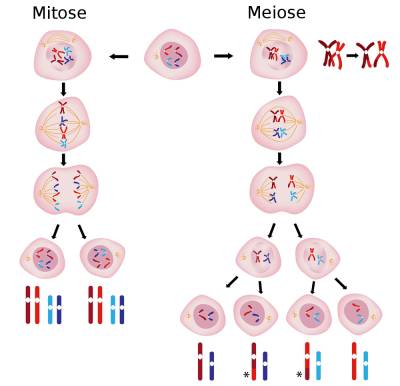
A divisão celular é a capacidade de uma célula se dividir dando origem à células filhas, existem dois meios de divisão celular: mitose e meiose. Assim se dá o crescimento microbiano, sendo relativo a aumento da quantidade de indivíduos. Este aumento se faz necessário porque esses organismos microscópicos possuem tempo de vida limitado e para poder garantir a sobrevivência da espécie dividem-se com a finalidade de gerar descendentes e assim perpetuar sua existência e permanência.
É um processo onde as células mães dão origem à células filhas através de dois processos de divisão. A mitose trata-se de uma sequência de eventos onde a célula originada tem o mesmo número de cromossomos que a célula mãe. Já no processo de meiose, a célula mãe origina quatro novas células contendo apenas metade dos cromossomos da progenitora.
Fissão Binária
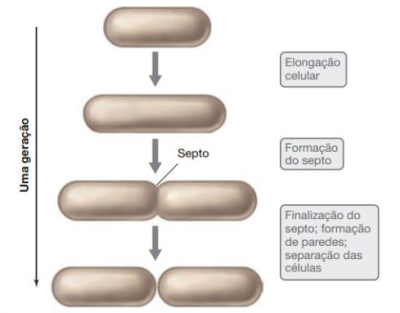
A divisão celular microbiana acontece por meio de fissão binária. Nesse processo, a célula em questão aumenta a quantidade de todos seus constituintes, sempre em proporção, consequentemente crescendo em extensão também, sendo que algumas bactérias como a Escheria coli podem chegar a quase o dobro do seu tamanho original. Após multiplicar cada componente celular, ocorre a formação de um septo que se dá pela invaginação da parede celular e da membrana plasmática, sendo que este septo continua crescendo até que as duas cavidades encontrem-se, resultando em uma divisão em duas células filhas. Em alguns casos essa divisão da célula primária pode ser feita sem constrição (Bacillus subtilis) ou até mesmo ter constrição mas sem formação do septo (Caulobacter). Em todos os casos citados, o tempo que o processo leva para ser executado, desde multiplicar seus constituintes até de fato a divisão em duas células, é chamado de Tempo de Geração. Esse tempo de geração é muito diverso nos casos de bactérias, sendo que alguns fatores como temperatura podem afetar no mesmo, uma vez que quanto mais ideal o ambiente para a divisão, mais rápido a mesma acontece.
Proteínas Fts
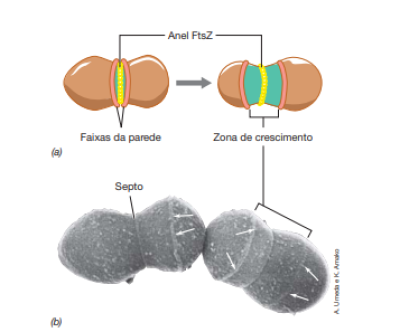
As proteínas Fts, são proteínas, presentes em todas as bactérias, responsáveis por ordenar a divisão celular. Uma delas, a proteína FtsZ, também conhecida como proteína-chave, exerce importante papel no processo de fissão binária, pois ela se polimeriza em um anel, “Anel Z”, localizado no centro da célula, determinando o seu plano de divisão, depois disso diversas outras proteínas se atraem por este anel, formando assim um complexo macromolecular chamado divissomo.
O processo de formação do divissomo ocorre depois do processo de elongação e replicação do DNA, como mostra a figura, portanto ele é o responsável pela formação do septo de divisão, comentado em fissão binária.
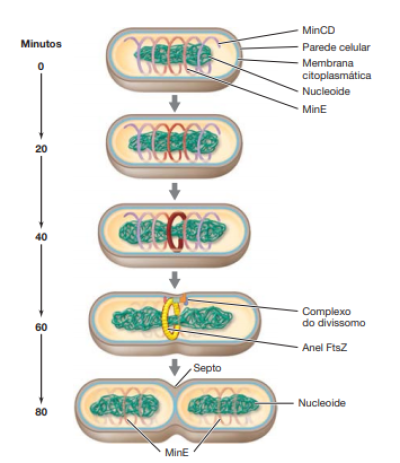
O posicionamento da proteína FtZ no centro da célula ocorre com o auxilio de proteínas chamadas Min. A proteína MinD forma uma espiral no interior da membrana citoplasmática e oscila pelo eixo da célula que está crescendo, prejudicando a formação do anel Z, ao mesmo tempo, a MinE oscila ao longo das extremidades da célula e isso faz com que MinD fique mais tempo nos polos, esse fenômeno faz com que somente o centro da célula seja um lugar propicio para a formação do anel Z, e consequentemente do divissomo.
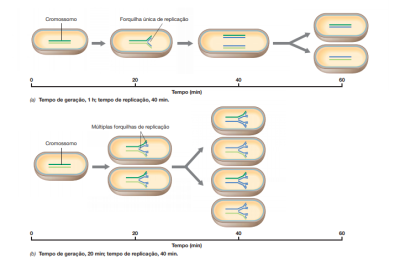
Durante a formação do septo de divisão, pode-se ter células que possuem múltiplas forquilhas de replicação, essas células possibilitam a ocorrência de replicações do DNA simultaneamente, isso que faz com que o tempo de duplicação do DNA ocorra pela metade, pois cada célula-filha recebe um cópia completa do genoma, como mostra a figura.
O entendimento desses processos na divisão celular é muito importante, pois ele possibilita o desenvolvimento de novos medicamentos que interfiram o crescimento de bactérias patogênicas em etapas especificas. [6]
Morfologia celular
Exitem proteínas específicas que definem a forma da célula, a principal delas é a MreB, esta proteína age de forma homologa a actina em células eucarióticas, sendo assim, responsável pela a formação de um citoesqueleto simples em bactérias e algumas arqueias.
Ela atua formando uma espiral ao longo da célula em crescimento e no contato dessa espiral com a membrana citoplasmática ligam-se peptideoglicanos, logo após, as MreB auxiliam na sintetização de uma nova parede celular ao redor desses pontos interligados, como mostra a figura:
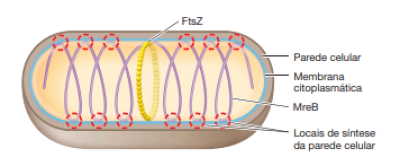
As células cocoides (esféricas) não produzem MreB, pois não possuem o gene que as codificam. Algumas células bacilar, também podem não conseguir codificar a MreB, tornando-se cocoides, isso ocorre porque a nova parede celular se forma a partir de um único ponto, em volta do Anel Z. Algumas espécies de bactérias, como a Caulobacter crescentus, necessita de uma outra proteína para a sua formação, chamada crescentina. Esta proteína produz pequenos filamentos que se organizam em uma face das células provocando uma curvatura [8].
Como foi comentado acima, a sintetização de uma nova parede celular depende da ligação de peptideoglicano recém formados na estrutura espiral formada pela MreB. O peptideoglicano é uma macromolécula, rica de ligações cruzadas, que quando sintetizado forne-se rigidez a parede celular. Além disso, a sua quantidade na célula que ira determinar se a sua parede será Gram Positivo ou Gram negativo, as Gram positivas possuem uma grande quantidade e as Gram negativas uma quantidade pequena. [9]
A síntese do peptideoglicano ocorre basicamente em três fases:
- Fase citoplasmática
- Fase membranar
- Fase perietal (traspeptidação).
Na fase citoplasmática, o peptideoglicano que é constituído basicamente por dois radicais, a N-acetil-glicosamina e ácido N-acetil-muramico (seus precursores), interage com uma molécula lipídica, no interior do citoplasma, chamada bactoprenol, que é um álcool C55 hidrofóbico, se tonando hidrofóbico [10].
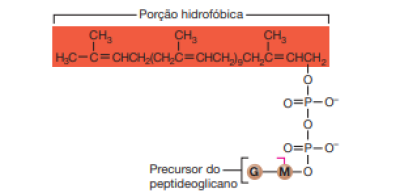
Na fase membranar, por se tornar hidrofóbico, ele consegue atravessar o interior da membrana citoplasmática. No exterior da membrana, o peptideogligano interage com enzimas denominadas autolisinas, que hidrolisam as ligações que conectam os seus precursores, criando assim pequenas aberturas no peptideoglicano, possibilitando a sua adição na parede celular, em bactérias Gram positivas esse processo causa uma assimetria, como mostra a figura.
A ultima fase da síntese da parede celular é chamada de transpeptidação, processo no qual forma-se ligações cruzadas peptídicas. Este processo é muito importante, pois é nesta etapa da síntese da parede celular que a penicilina (antibiótico) age, interrompendo este processo, causando assim o seu rompimento da célula[13].
Crescimento Populacional
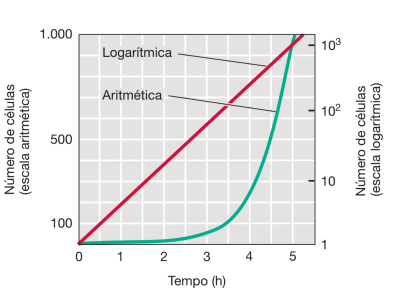
Analisar o crescimento microbiano é de suma importância para a microbiologia, principalmente para microbiologia ambiental, é interessante analisar o crescimento populacional microbiano de maneira quantitativa, de maneira a estudar e entender como é o aumento de toda a comunidade e não apenas o tempo e crescimento de um indivíduo. Em termos de velocidade de crescimento, observa-se que em suma crescem de maneira exponencial, o que informa aumento rápido da população. Por possuir caráter exponencial, possuem funções matemáticas que descrevem o crescimento da comunidade, sendo que cada função difere para cada microrganismo distinto. A seguir é possível notar a curva exponencial de crescimento e que a mesma foi linearizada utilizando logarítmicos, sendo a curva verde a função de aumento da população e a reta vermelha a mesma função de maneira linear.
Aspectos quantitativos do crescimento microbiano
A divisão celular é a transformação de uma célula em duas, onde há a duplicação do número total de células e de massa. No aspecto microbiano, o crescimento pode tornar-se elevado com certa rapidez, por isso surge esse enfoque em trabalhar com esses números de maneira quantitativa, levando em conta sua taxa de crescimento, que é a variação do número de células por unidade de tempo.
Dado um experimento de crescimento com apenas uma célula inicial, com tempo de geração em 30 minutos, conforme visto na figura acima.
A Matemática e as expressões do crescimento microbiano
Crescimento exponencial é nome dado, ao aumento populacional padrão em que as células duplicam em um intervalo de tempo padronizado.
Podemos basear o aumento de células de uma cultura bacteriana em uma progressão geométrica básica de quociente 2. Ou seja, 2°, 2¹, 2²,2^n em cada etapa das divisões, podemos reduzir a um expressão comum: N=Ni2^n, Sendo: N o número final de células, Ni o número inicial de células e n o número de gerações formadas durante o período de crescimento.
Outra grandeza importante quando se fala de crescimento microbiano é o tempo de geração (g) que pode ser expressado por t/n , sendo t, a duração fixada da exponencial, podendo ser em dias, horas ou minutos. Podemos expressar a função N=Ni2^n em termos logaritmos, sendo assim: N=Ni2^n ⇒ logN=logNi+nlog2 ⇒ logN-logNi=nlog2 ⇒ n=(logN-logNi)/log2 ⇒ n=(logN-logNi)/0,301 ⇒ n=3,3(logN-logNi).[1].
Outra maneira de calcular o tempo de geração (g) é a partir da inclinação da função linear obtida a partir de um gráfico exponencial. Sendo que ela pode ser expressada por (0,301*n)/t ou simplesmente por (0,301/g), é denominada taxa específica de crescimento e pode ser abreviada pork.
Mais uma expressão que surge a partir dessa análise numérica dos dados do crescimento microbiano é a taxa de divisão, que pode ser expressa por v, e é descrita por (1/g).
Todos esses cálculos expressos acima tornam-se úteis para otimizar as condições de cultivo de um organismo recentemente isolado e também para avaliar os efeitos de algum tratamento sobre a cultura em questão.
As consequências do crescimento exponencial
Por se tratar de função exponencial, podemos observar que a parte inicial do crescimento é relativamente lenta, comparada com o final, onde pode-se enxergar aumentos significativos no número de células, portanto quando se trata de uma patologia é prioritário o controle desse crescimento no primórdio do ciclo de crescimento, entretanto quando trata-se de um processo benéfico é utilizado de mecanismos como a temperatura para acelerar esse início lento do ciclo.
Podemos observar, além dessa construção teórica de crescimento exponencial que pode ser vista na vida cotidiana, como por exemplo no processo de deterioração do leite, onde as bactérias do ácido lático(responsáveis pelo sabor azedo do leite estragado) são pasteurizadas em menor número e crescem lentamente na temperatura da geladeira (4°C) e mais rapidamente em temperatura ambiente (25°C).
O ciclo de crescimento
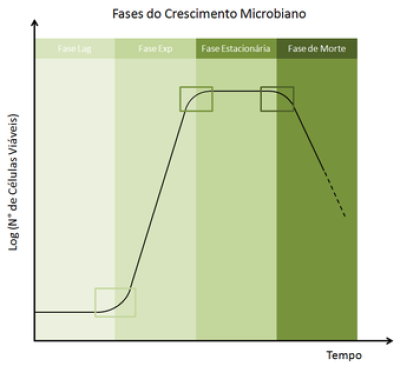
O crescimento apresentado anteriormente possui ciclos, não acontece inteiramente de maneira exponencial. Pode ser dividido em 3 fases, sendo elas a fase de latência ou fase “lag”, fase exponencial ou fase “exp”, fase estacionária e fase de morte. É importante informar que as fases citadas são observadas em laboratório, com ambiente controlado para estudo.
Fase Lag
É o momento inicial de uma cultura de microrganismos também novos, sem serem utilizados anteriormente. Carrega esse nome porque é quando os organismos em questão crescem de maneira mais lenta. Isso ocorre pelo fato de que estes seres vivos recém introduzidos no novo meio precisam biosintetizar novos componentes, precisam adaptar-se ao novo local que estão sendo inoculados, proteger-se e sobreviver. Isso feito, torna-se mais rápida a multiplicação dos mesmos, nos levando para a próxima fase. É importante salientar que caso organismos que já estão na faze exponencial sejam submetidos a um ambiente novo, os mesmos podem se manter em crescimento exponencial, sendo pouco afetados.
Fase exponencial
É a fase de crescimento mais intenso e rápido dos microrganismos. Apresentam-se células saudáveis e com funcionamento normal, sendo o momento mais propício para estudar tais seres vivos. Aqui, o crescimento é descrito como no gráfico anteriormente mostrado, sendo bem veloz e disponibilizando um aumento substancial da população dos organismos em questão.
Fase estacionária e morte
Aqui acontece o momento o qual a população dos microrganismos chega no seu tamanho máximo em decorrência da limitação de fatores do meio como disponibilidade de nutrientes. Não há crescimento da comunidade microbiana, sendo que algumas células até podem dividir-se, porém, outras morrem na mesma velocidade que novas surgem. A partir daqui, por conta dos fatores limitantes, a população em questão começa a morrer ocorrendo a perda irreversível da capacidade de divisão celular. Tal origina um decréscimo da concentração de células viáveis na população microbiana ao longo do tempo, interessante salientar que algumas culturas podem sobreviver por até um ano após ter alcançado essa última fase em questão.
Além das fases descritas, é importante abordar um ponto importante chamado de Cultura contínua.
Cultura contínua
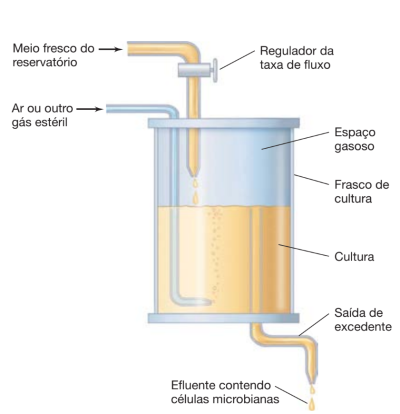
Como o nome informa, ocorre de maneira constante e serve para analisar e manter os organismos na fase exponencial por dias e até semanas, que como foi dito, é a qual os seres vivos microscópicos possuem mais saúde e atividade regular, sendo o melhor momento e situação para serem estudados, descritos e entendidos. É dito um sistema aberto e tem por objetivo fazer com que as células estudadas atinjam o equilíbrio, justamente para que não saiam da fase de estudo desejada. Para tal, é feito o uso de um aparelho chamado quimiostato. Esse dispositivo permite criar organismos num meio que possui a entrada de novos nutrientes e a saída dos utilizados, de forma que o ambiente é renovado constantemente. A fase exponencial é assegurada pois ao mesmo tempo que novos nutrientes chegam algumas células também são retiradas do meio juntamente com o que é drenado para ser trocado. Observa-se a seguir a representação de um quimiostato.
A a relação da quantidade de meio que é renovado e drenado é importante e é chamada taxa de diluição. Se o ambiente apresentar uma taxa de diluição alta demais, os organismos não conseguem multiplicar-se em velocidade necessária para manterem sua diluição e são eliminados do quimiostato. Em contrapartida, se a mesma taxa for muito baixa, os microrganismos podem vir a morrer de desnutrição. Logo, é evidente a necessidade do equilíbrio ser mantido afim de manter a cultura com sucesso. É interessante citar a relação da concentração do nutriente que está sendo injetado no meio sendo que quanto mais concentrado e consequentemente mais nutritivo for a solução introduzida, maior vai ser a densidade populacional, porém, a taxa de crescimento da comunidade não se altera.
Modelo de Crescimento de Monod
O modelo de crescimento de Monod ou equação de Monod, apresentado em 1949 por Jacques Monod, sugere utilizar uma equação para associar parâmetros de crescimento microbiano em ambientes aquosos com concentração limitante de nutrientes.[15] O crescimento da biomassa depende da oportunidade de nutrientes.
Seu modelo é idêntico ao de Michaelis-Menten, proposto para descrever a velocidade de reações catalisadas enzimáticas[16], enquanto o de Monod utilizada-se em lodos ativados durante o processo de tratamento de esgoto.
Os microorganismos apresentam diferentes ciclos de vida, formados por diferentes etapas (cada uma representada na imagem abaixo), que por sua vez são caracterizadas por diferentes taxas de crescimento.[17]
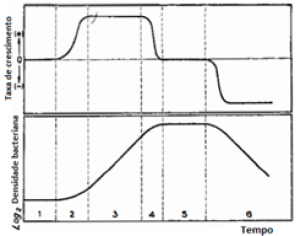
Fases:
- Fase de Aceleração. Fase em que a velocidade de crescimento aumenta;
- Fase de Retardo. Fase em que o desenvolvimento dos microrganismos decresce;
O modelo de Monod apresenta a desvantagem de não explicar as fases de lag e declínio, apenas demonstram as fase de crescimento exponencial e fase lag.
A Equação de Monod baseia-se na observação da relação não linear entre a concentração de substrato e a crescimento microbiano. Tal relação resulta na taxa de crescimento específico da concentração microbiana como função da concentração do substrato limitante e da constante de saturação:[19]
Onde:
μ = velocidade específica de crescimento dos microrganismos [h-1];
μmax = a velocidade específica de crescimento máxima dos microrganismos [h-1];
Ks = constante de saturação (igual a S quando μ = 0,5μmax) [gL-1];
S = concentração total de nutrientes[gL-1 TOC].
Aplicação em Lodos Ativados
O lodo ativado amplamente utilizado para tratamento de efluentes utiliza-se de bactérias aeróbias (necessitam de O2 durante o processo) para realizar oxidação da matéria orgânica.[20] O processo biológico constitui-se em:[21]
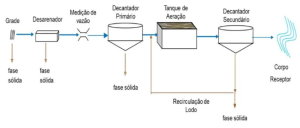
- Tanque de aeração: ocorre a mistura entre o esgoto e o lodo ativado (com microorganismos), insere-se o oxigênio através de um processo mecânico de agitação ou ar comprimido. Resulta a degradação orgânica e formação de flocos.
- Decantador secundário: nesse tanque ocorre a decantação (sedimentação no fundo do tanque) dos flocos resultando em um efluente clarificado com condições de ser enviado para o corpo receptor.
- Descarte do lodo: descarte do lodo excedente.
- Recirculação: restante da biomassa retorna ao sistema, idade do lodo é mantida, garantindo alta eficiência de biodegradação.
Fatores Ambientais de Crescimento
Das condições que influenciam o meio físico de um microrganismo, podemos destacar quatro como principais, sendo estas: Temperatura, pH, Atmosfera Gasosa e Pressão Osmótica. O cultivo exitoso para a vasta quantidade de microrganismos requer um arranjo de nutrientes apropriados e de condições físicas apropriadas. Por isso, é necessário conhecer quais são as suas necessidades específicas para o seu desenvolvimento ideal.
Temperatura
A temperatura apresenta uma demasiada influência no crescimento microbiano, impactando a taxa de crescimento, assim como o tipo de reprodução. Posto que os processos de crescimentos são restritos de reações químicas, onde são alusivos à temperatura. A temperatura na qual uma espécie de microrganismo cresce mais aceleradamente é a temperatura ótima de crescimento. Existem três temperaturas importantes para o crescimento microbiano são elas: mínima, ótima e máxima (temperaturas cardinais).
As temperaturas cardinais de uma determinada espécie variam para cada estágio no ciclo de vida do microrganismo e com o seu conteúdo nutricional disponível. Todavia, a temperatura ideal para o seu desenvolvimento pode não ser a temperatura ideal pra toda a atividade celular. A temperatura ótima para uma espécie microbiana é o limite superior da variação de temperatura, pois com o aumento da temperatura há o aumento da velocidade das reações enzimáticas. Os microrganismos são divididos em três grupos, de acordo com a variação de temperatura na qual se desenvolvem:
I) Psicrófilos, ou microrganismos que crescem em baixas temperaturas. Eles se desenvolvem melhor em temperaturas de 15 a 20ºC, emboram possam se desenvolver em temperaturas mais baixas.Eles são encontrados em águas frias e solos tais como os oceanos e nas regiões polares. Grande parte dos microrganismos marinhos pertencem a esse grupo. Existem bactérias do gênero Pseudomonas, Flavobacterium e Alcaligenes que são psicrófilos, assim como fungos, algas e protozoários.
II) Mesófilos, ou microrganismos que crescem em temperaturas moderadas. Grande parte dos microrganismos que conhecemos fazem parte dessa categoria. Eles se desenvolvem melhor em temperaturas que variam de 25 a 40ºC. Entre os mesófilos, estão grande parte dos microrganismos patogênicos que se desenvolvem próximo da temperatura corporal, que é 37ºC. A temperatura alta de uma febre inibe o crescimento desses patógenos. Há também os microrganismos que degradam os alimentos.
III) Termófilos, ou microrganismos que crescem em altas temperaturas. Grande parte desses micriorganismos crescem a temperaturas na faixa de 40 a 85ºC, mas se desenvolvem melhor entre 50 e 60ºC. São encontrados em regiões vulcânicas e em nascentes quentes. Vale ressaltar que grande parte dos microrganismos termofílicos são procarióticos. Suas enzimas são produzidas mais aceleradamente do que em comparação aos mesófilos, embora elas sejam danificadas pelas altas temperaturas são rapidamente substuídas. Como exemplo, temos algumas arqueobactérias que são termofílicas, como o Pyrodictium occultum, Pirococcus woesei eThermococcus celer. A maioria das termófilas extremas são arqueobactérias, que têm membranas que são quimicamente distintas das eubactérias, as arqueobactérias possuem longas cadeias de éter lipídico, que são mais termostáveis.
O fator pH
O pH é uma escala criada para medir a acidez de um meio, sua escala é definida de 0 a 14, no qual de 0 < pH < 7 é considerado meio ácido, pH = 7, neutro e 7 < pH < 14, meio básico. Como outros fatores, o microrganismo precisa na maioria dos casos estar em meio ácido para que ocorra o crescimento, porém dependendo muito das características do microrganismo analisado, sendo possível pH mais altos.
Como cada organismo depende da faixa de pH favorável para o crescimento, foi definido nomes para o respectivo microrganismo, pH de 5 a 9 são chamados de neutrófilos, pH abaixo de 5 ou inferiores, são denominados acidófilos, e microrganismos que o meio favorável possui um ph de 8 para cima é chamado de alcalifílicos. Alguns crescem melhor em pH ácido e outros em pH baixo. Mas muitos são incapazes de crescer em valores de pH mais do que duas unidades acima ou abaixo do seu ideal.
Um fator relevante em relação aos microrganismos acidófilos é a respeito da estabilidade da membrana citoplasmática, por exemplo, quando uma bactéria acidófila é exposto a um pH neutro, as membranas citoplasmáticas são destruídas, com as células sofrendo lise. Sendo assim possível concluir que é necessário que o microrganismo esteja em meio ácido para que se permaneça estável. O pH favorável para o crescimento de qualquer organismo é uma medida apenas do pH do meio extracelular. Porque com o proposito de evitar a destruição das macromoléculas o meio intracelular se mantém neutro pois o DNA é instável em condições ácidas e o RNA, em meios alcalinos.
Para evitar mudanças significativas no pH durante o crescimento microbiano no processo de batelada, as soluções tampões são introduzidos na cultura, juntamente com outros componentes necessários para o crescimento, no entanto, o tampão funciona apenas sobre uma gama de pH relativamente estreita, por isso diferentes soluções tampões são utilizados para diversas classes de microrganismos. Em suma, o melhor tampão para o crescimento de microrganismos específicos deve geralmente ser escolhido de forma empírica.
Atmosfera Gasosa
Os microrganismos necessitam de quantidades distintas de gases tais como o oxigênio, dióxido de carbono, nitrogênio e metano. Alguns gases podem ser necessários para o metabolismo celular, outros podem ser tóxicos às células. Os principais gases que afetam o crescimento das células microbianas são o dióxido de carbono, que é utilizados por todas as células para determinadas reações químicas e o oxigênio, esse é altamente necessário para alguns microrganismos, mas tóxico para outros.De acordo com o estímulo do oxigênio gasoso, os microrganismos são classificados em quatro grupos fisiológicos: microrganismos aeróbios, facultativos, anaeróbios e microaerófilos.
I) Microrganismo Aeróbios, são microrganismos que necessitam de oxigênio para o crescimento. Podem viver na atmosfera padrão com 21% de oxigênio. Eles conseguem obter mais energia dos nutrientes disponíveis em comparação aqueles que não utilizam oxigênio. Um exemplo, são os fungos filamentosos e as bactérias do gênero Mycobacterium e Legionella.
II) Microrganismo Facultativos, são microrganismos que podem crescer na presença de oxigênio (respiração), como também em anaerobiose (fermentação). Sob condições anaeróbias, eles obtêm energia através da fermentação. Alguns exemplos são a Escherichia coli e a Saccharomyces cerevisiae, essa muito utilizada na panificação.
III) Microrganismos Anaeróbios, são microrganismos que não utilizam oxigênio para as reações de produção de energia, crescem melhor na ausência de oxigênio. Alguns anaeróbios toleram baixas concentrações desse gás, mas os anaeróbio estritos são disseminados por qualquer exposição ao oxigênio. Há uma grande variedade de níveis de tolerância ao oxigênio entre os microrganismos anaeróbios, dentre eles o Clostridium perfringens(altamente tolerante) e o Clostridium tetani(moderado) já o Methanobacterium e o Methanospirillum são anaeróbios estritos. A toxidade do oxigênio para anaeróbios deve-se a formação do radical superóxido.
IV) Microrganismos Microaerófilos, são microrganismos similares aos anaeróbios, porém com uma restrição, toleram níveis de oxigênio variando de 1 a 15%.Podem utilizar oxigênio nas reações químicas para a produção de energia. Esta tolerância deve-se à alta susceptibilidade aos radicais peróxido e peróxido de hidrogênio, que são formadas sob condições de anaerobiose. Um exemplo é a Campylobacter jejuni, bactéria que causa diarréia em humanos.
O Fator Osmolaridade
Disponibilidade da água é um importante fator que interfere no crescimento microbiano. Tal fator não depende somente do ambiente ser úmido ou seco, mas da concentração de solutos dissolvidos por exemplo. Os solutos se ligam à água, tornando-a menos disponível aos organismos, portanto, para que os organismos contornem esta situação, ajustes fisiológicos são necessários.
A disponibilidade de água é contabilizada em termos de atividade de água, a razão entre a pressão de vapor do ar em equilíbrio com uma substância ou solução, em relação à pressão de vapor da água pura. Valores de atividade de água podem variar entre 0 a 1.
A água difunde-se a partir de regiões de alta concentração aquosa e baixa concentração de solutos para regiões de menor concentração aquosa e maior concentração de soluto, um processo denominado osmose. O citoplasma de uma célula apresenta concentração de solutos maior em relação ao meio externo, de modo que a água difundir-se para o interior da célula. Nessas condições, diz-se que a célula está em equilíbrio aquoso positivo, que é o seu estado normal.
Porém, quando a célula se encontra em um ambiente onde a concentração do soluto excede a do citoplasma, a água partirá para fora da célula. Esse fenômeno poderá acarretar graves problemas, caso a célula não possua mecanismos para reverter esse processo, pois uma célula quando desidratada não consegue crescer.
Halófilos e outros organismos
Os efeitos osmóticos são cruciais em hábitats com altas concentrações de salinidade. Os microrganismos marinhos na maioria da vezes têm uma necessidade pelo composto de NaCl, além de apresentarem crescimento ótimo na atividade de água do mar. Esses organismos são denominados halófilos. O crescimento de tais demanda uma quantidade especifica de NaCl, no entanto o melhor valor muda conforme o organismo.
Por exemplo, os microrganismos marinhos na maioria das vezes crescem melhor com 1% a 4% NaCl, os organismos de ambientes hipersalinos, com 3% a 12% e os organismos de ambientes extremamente hipersalinos é necessária uma concentração ainda maior de NaCl. O requisito de NaCl pelos halófilos é absoluto e não pode ser substituído por outros sais. Diferentemente dos halófilos, que suportam um grau de solutos dissolvidos. Halófilos que crescem em ambientes com altas concentrações de sal são denominados halófilos extremos, requerem 15 a 30% de NaCl para crescimento, são impossibilitados de crescerem em concentrações de NaCl abaixo desse nível.
Organismos que sobrevivem em ambientes saturado de açúcar como soluto são denominados osmófilos, e aqueles que crescem em ambientes extremamente secos são denominados xerófilos.
Oxigênio e Crescimento Microbiano
Para todo o crescimento populacional e desenvolvimento estrutural de um microorganismo a principal fonte de energia para a manutenção de seu metabolismo advém através da ingestão de nutrientes e da respiração. No entanto, os microorganismos divergem entre si quanto as suas capacidades de respiração em relação ao meio ambiente, ou seja, há aqueles microorganismos que não estão aptos para sobreviverem em locais com presença de oxigênio e também aqueles que dependem de oxigênio para realizar a respiração.
Desse modo, de acordo com (Brock, 2014), os microorganismos são classificados em classes e subclasses quanto a sua respiração, e estes estão subdivididos em:
*Aeróbios: São os microorganismos que utilizam do O2 para realizar a respiração e manter o metabolismo em atividade. Consequentemente, os aeróbios dependem das moléculas de oxigênio, mas nem sempre utilizam dessa molécula para realizar as suas atividades e por isso os microorganismos aeróbios são classificados quanto a sua relação com o oxigênio. Dessa forma, temos que:
- Aeróbios Obrigatórios: São os microorganismos que somente usam das moléculas de O2 para a sua atividade metabólica. Geralmente presentes em locais onde a concentração desta molécula é alta, como por exemplo, na atmosfera (que contem 21% de O2 no ar).Um exemplo de um ser vivo aeróbio obrigatório é a bactéria Micrococcus luteus.
- Aeróbios Facultativos: Em conformidade com (Brock, 2014) os seres aeróbios facultativos tem como característica o uso do O2 para respiração quando este se encontra disponível no meio, no entanto, quando não há a disponibilidade da molécula de O2 o microorganismo recorre a processos fermentativos quando este está ausente. Um exemplo dessa classe é a bactéria Escherichia coli.
- Microaerófilos: Os microaerófilos são microorganismos na qual possuem uma limitação na sua respiração quando o meio esta com uma concentração alta de moléculas de 02. Isto se deve pela presença de alguma molécula ou enzima sensível à absorção do oxigênio no microaerófilo. Dessa forma, a respiração desses seres vivos só ocorre em locais cuja concentração de O2 seja menor que a concentração na atmosfera, ou seja,em lugares de condição micro-óxicas. A bactéria Spirillum volutans é um exemplo desta classe.
*Anaeróbios: Considerados como os microorganismos que não são capazes de realizar a respiração através das moléculas de O2. No entanto, alguns desses seres anaeróbios convivem com o oxigênio, porém não o utilizam; e por este motivo, a subdivisão dos seres anaeróbios é feita em:
- Anaeróbios Aerotolerantes: São aqueles microorganismos que possuem relação de convivência com as moléculas de oxigênio mas não são afetados por ela. O seu metabolismo é designado para ter a respiração por fermentação. Um exemplo de aerotolerante é a bactéria Streptococcus pyogenes.
- Anaeróbios Obrigatórios: Caracterizado como um ser vivo que não necessita de O2 para o funcionamento de seu metabolismo, pois a fermentação é a sua única forma de respiração. Ademais, quando um anaeróbio obrigatório entra em contato com o oxigênio, este pode vim a morte, pois o O2 é transformado em componentes tóxicos sendo que os anaeróbios obrigatórios podem não possuir as enzimas essenciais para estabilizar esses componentes, o que no caso, resulta em morte. A archea Methanobacterium formicicum é um exemplo desta classe.
Posto isso, os seres aeróbios diferem dos seres anaeróbios devido a sua respiração, mas também pelo fato de possuírem enzimas que catalisam os componentes tóxicos que são formados pela ingestão de O2 e desse modo, impedem a exposição do organismo as transformações do O2. [23]
Fitopatologia
A Fitopatologia é a ciência que estuda as doenças que atingem as plantas. O estudo abrange as alterações causadas desde microrganismos, insetos, outros animais, fungos, bactérias, assim como plantas parasitas e fatores climáticos. Assim sendo, a fitopatologia estuda de forma geral as circunstâncias inseridas ao ambiente responsável pelas doenças em plantas; também, as relações entre a doença e a planta, controle da mesma e ferramentas de prevenção. [24]
Fitopatologias de Grandes Produções Agrícolas
Algumas das principais fitopatologias presentes nas grandes produções agrícolas brasileiras serão listadas a seguir, de modo a descrevê-las e evidencias formas de monitoramento e controle das mesmas. As grandes produções evidenciadas baseiam-se em dados da CONAB (Companhia Nacional de Abastecimento) para as safras de 2019/2020. Bem como, as fitopatologias abordadas serão as principais encontradas em grandes proporções de produção e rentabilidade do agronegócio, sendo:
- Soja (produção: 120,423 milhões de toneladas);
- Cana-de-açúcar (produção: 642,769 milhões de toneladas);
- Milho (produção: 100,992 milhões de toneladas);
- Café (produção: 3,575 milhões de toneladas).
*Dados de produção retirados de CONAB 2020.
- Soja [25]
| N° | Fitopatologia | Agente Causador |
|---|---|---|
| 1 | Antracnose | Colletotrichum truncatum (fungo) |
| 2 | Cancro de Haste | Diaporthe aspalathi (fungo) |
| 3 | Ferrugem | Phakopsora meibomiae (fungo) |
| 4 | Mancha Parda | Septoria glycines (fungo) |
1) Antracnose
Descrição: esta doença afeta a fase inicial de formação das vagens e ocorre com maior frequência nos Cerrados, por causa da elevada precipitação e das altas temperaturas. Essencialmente afeta com maior frequência as vagens, causando redução do número das mesmas, induzindo a planta à retenção foliar e à haste verde.
Controle: Recomenda-se o uso de sementes sadias, tratamento de sementes, rotação de culturas, espaçamento entre fileiras e estande que permitam bom arejamento da lavoura e manejo adequado da fertilidade do solo, principalmente com relação ao elemento potássio (K).
2) Cancro de Haste
Descrição: É uma doença de evolução lenta, pois as infecções ocorridas logo após a emergência formam cancros somente entre a floração e o enchimento das vagens. Afetando significativamente as plantas em seus estádios fenológicos primários, já que as plantas adultas adquirem resistência à doença.
Controle: A forma mais eficiente de controle da doença é pelo uso de cultivares resistentes. Outras medidas são: o tratamento de sementes, rotação da cultura com algodão, arroz, girassol, milho ou pastagem; semeadura com maior espaçamento entre as linhas e entre plantas; adubação e calagem equilibradas. O tratamento de sementes com fungicidas sistêmicos mais fungicidas de contato.
3) Ferrugem
Descrição: O processo de infecção depende da disponibilidade de água livre na superfície da folha, sendo necessárias de 6 a 12 horas de molhamento foliar para que haja a infecção da planta. Também temperaturas entre 18 e 26,5°C são favoráveis para a infecção. Esta infecção, quando atinge seu ápice, provoca a queda das folhas da planta, e quanto mais cedo ocorrer a desfolha, menor será o tamanho dos grãos e, consequentemente, maior a perda do rendimento e da qualidade.
Controle: O controle com fungicidas formulados em mistura de diferentes grupos químicos tem-se mostrado eficiente. O fungicida deve ser aplicado preventivamente ou nos primeiros sintomas da doença. Deve-se realizar a semeadura no início da época recomendada, além de utilizar preferencialmente cultivares precoces e cumprir o vazio sanitário.
4) Mancha Parda
Descrição: A infecção e o desenvolvimento da doença são favorecidos por condições quentes e úmidas. A dispersão dos esporos ocorre pela ação da água e do vento. Infecções severas podem causar desfolha e até maturação precoce.
Controle: Em razão da sobrevivência do fungo nos restos culturais, o controle mais eficiente é obtido pela rotação de culturas, acompanhado da melhoria das condições físico-químicas do solo, com ênfase na adubação potássica.[5]
- Cana-de-Açúcar [26]
| N° | Fitopatologia | Agente Causador |
|---|---|---|
| 1 | Carvão | Ustilago scitaminea (fungo) |
| 2 | Ferrugem | Puccinia melanocephala (fungo) |
| 3 | Raquitismo da Soqueira | Leifsonia xyli subsp. xyli (bactéria) |
1) Carvão
Descrição: Os danos oriundos da infecção pelo carvão são variáveis, mas podem causar perdas de até 100%. O carvão é caracterizado por ser umas das doenças de maior facilidade de diagnóstico, pois apresenta a emergência de um chicote, que consiste em uma modificação do meristema apical do colmo, induzida pelo fungo, com comprimento de até mais de 1 metro. O chicote é composto por parte do tecido do fungo e da planta possuindo milhões de esporos. Plantas doentes, antes de emitirem o chicote, têm colmos mais finos que o normal e touceiras com superbrotamento.
Controle: O controle da doença de maior eficiência é o uso de variedades resistentes, sendo estas variedades resistentes produzidas através de clonagem das mesmas e eliminação das mais suscetíveis a doença, até que se alcance um uma variedade mais resistente a fitopatologia.
2) Ferrugem
Descrição: a doença causada pelo fungo gera perdas de até 50% na produção (dependendo do cultivar). Os sintomas característicos da ferrugem são: presença de pústulas na face inferior da folha, possuindo uma coloração que vai de amarelada a marrom-escuro.
Controle: A prática de controle recomendada para a doença é o uso de variedades resistentes. Resistência ao agente causal da ferrugem é um fator primordial em programas de melhoramento da cultura.
3)Raquitismo da Soqueira
Descrição: os sinais da infecção pela bactéria não são fáceis, pois não apresentam mudanças significativas na parte externa da planta. Para diagnóstico eficaz da doença, metodologias têm sido empregadas como: microscopia de contraste de fase, testes sorológicos e reações sorológicas de fluorescências. Com o desenvolver da doença, e diagnóstico tardio, percebe-se que os colmos tornam-se mais finos e internódios curtos causando a redução da produtividade agrícola.
Controle: A principal forma de controle dessa doença é por meio de resistência da variedade, porém uma das maiores dificuldades é a seleção de qualidades resistentes, sabendo-se que seu diagnóstico é de elevada complexidade, baseando-se no tempo e efetividade do mesmo.
- Milho [27]
| N° | Fitopatologia | Agente Causador |
|---|---|---|
| 1 | Antracnose | Colletotrichum graminicola (fungo) |
| 2 | Ferrugem Comum | Puccinia sorghi (fungo) |
| 3 | Mancha Branca | Pantoea ananas (fungo) |
| 4 | Podridão Seca do Colmo | Macrophomina phaseolina (fungo) |
1) Antracnose
Descrição: A resistência a utilização de rotação de cultura e a utilização do cultivo mínimo e do plantio direto, são grandes influências para a manutenção e elevação desta infecção na lavoura brasileira. Em sua fase inicial (a fase foliar), a doença apresenta características como a presença de lesões de formas variadas, o que pode dificultar a identificação. Já nas nervuras, é comum a presença de lesões elípticas bem definidas.
Controle: Como apresentado como influenciadora da disseminação desta infecção, a utilização da rotação de culturas possui grande efetividade ao controle desta fitopatologia, já que permite um período de vazio sanitário das pragas que a cultura possui.
2) Ferrugem Comum
Descrição: No Brasil, a doença possui ampla distribuição com severidade de índice moderado [7]. As pústulas são desenvolvidas na parte área da planta, possuindo maior abundância nas folhas. A ferrugem comum apresenta pústulas em ambos lados das folhas (superior e inferior), as quais apresentam formatos circular e alongados.
Controle: A alternativa efetiva contra este fungo é o plantio de cultivares que possuam maior resistência ao mesmo.
3) Mancha Branca
Descrição: conhecida também como “mancha de Phaeosphaeria”, Esta doença tem grande presença em todo território brasileiro, podendo gerar perdas de até 60% da produção. As lesões iniciais apresentam uma aparência de encharcamento, tornando-se necróticas (células mortas) com coloração palha. Também há a coalescência de lesões em ataques mais severos.
Controle: O plantio realizado com antecedência pode reduzir a severidade da infecção da doença. Também, a rotação de culturas pode ser empregada a fim de reduzir o potencial de inóculo, além da utilização de cultivares resistentes.
4) Podridão Seca do Colmo
Descrição: A infeção das plantas se inicia pelas raízes. No entanto, a infecção pode ocorrer nos primeiros estádios de desenvolvimento da planta, com sintomas visíveis nos entrenós na base da planta, após a polinização. Internamente, o tecido da medula se desintegra permanecendo apenas os vasos lenhosos, provocando uma coloração acinzentada no interior do colmo.
Controle: Utilização de cultivares com resistência. Além disso, a promoção de uma irrigação adequada em anos de déficit hídrico; evitar elevadas densidades de semeadura; e evitar desiquilíbrios nutricionais através de adubações corretas.
- Café [28]
| N° | Fitopatologia | Agente Causador |
|---|---|---|
| 1 | Ferrugem | Hemileia vastatrix (fungo) |
| 2 | Cercosporiose | Cercospora coffeicola (fungo) |
| 3 | Manchas de Phoma | Phoma costarricensis (fungo) |
1) Ferrugem
Descrição: Também referida como “ferrugem alaranjada”, o fungo causador é biotrófico, ou seja, alimenta-se das células vivas da planta, penetrando pelo estômato da folha, onde germina e se desenvolve, sem extinguir a célula. Seu desenvolvimento pode ser favorecido por baixa altitude, umidade relativa alta, temperaturas amenas (20 24°C) e baixa luminosidade. O sinal conhecido e distinto da ferrugem é a presença de uma massa de esporos de coloração que tendem do amarelo ao alaranjado, de aspecto pulveroso na face inferior da folha.
Controle: Controle químico, tanto preventivo como curativo (quando já há a infecção de plantas pela fitopatologia) e controle cultural. O controle cultural pode ser realizado através da divisão da lavoura em talhões homogêneos, o que retarda a disseminação; adoção de espaçamento entre as plantas para arejamento adequado; adubações equilibradas; e podas sistemáticas.
2) Cercosporiose
Descrição: O desenvolvimento do fungo é bem favorecido pela umidade relativa alta, alta luminosidade ou insolação excessiva, além da nutrição tanto a desequilibrada como a deficiente. O sintoma característico são lesões de tamanho pequeno (até 1,5 cm), proximamente a circunferências, coloração que varia do marrom pardo ao cinza claro e envolto por um halo amarelado. E estas lesões podem apresentar-se tanto em folhas como nos frutos.
Controle: O controle da doença pode ser químico, cultural ou a associação de ambos. Instalação de viveiros em lugares arejados e bem drenados; manter mecanismos de controle de insolação; proteção contra ventos frios; rigoroso controle de irrigação para evitar déficits e excessos.
3) Manchas de Phoma
Descrição: A doença conhecida como Phoma ou Requeima, o fungo que causa a doença é caracterizado como um parasita necrotrófico, logo, desenvolve-se com a construção de tecidos vivos, matando as células da planta durante este processo de colonização. O desenvolvimento deste é favorecido por umidade relativa alta, período chuvoso. A infecção, no início, aparece às margens de estradas e carreadores sujeitos a ventos frios, possuindo uma grande taxa de disseminação. A infecção deve ser observada em folhas novas, no momento inicial ou final de períodos de longas chuvas.
Controle: a recomendação é que aja uma associação de medidas de ordem cultural com o uso de fungicidas, sendo as medidas de ordem cultural: implantação de quebra ventos e evitar excesso de nitrogênio nas adubações [8].
Controle de Fitopatologias
O controle do crescimento microbiano pode ser feito pela limitação ou inibição da proliferação celular, bem como pela eliminação por esterilização, essencial em muitos casos, e inviável para outros. A descontaminação (Remoção física de elementos contaminantes, de modo a torna-los seguros para o manuseio) e a desinfecção (Processo físico ou químico feito com o auxílio de desinfetantes, direcionado para patógenos), são exemplos de controles microbianos. Métodos como o uso do calor, radiação e filtração são utilizados para destruir ou remover micro organismos.
Controle do crescimento pelo calor
Dentre ao processos citados acima, o controle microbiano pelo calor é o mais utilizado, tanto pela facilidade como acessibilidade. Micro organismos possuem uma faixa de temperatura onde o crescimento é possível o crescimento (entre 50º~90º, a eliminação de esporos requer temperaturas de 121ºC[29]), se a temperatura do meio é maior do que a temperatura máxima de sobrevivência então o crescimento dos microrganismos é inibido por processos como destruição de estruturas chaves ou desnaturação de proteínas, por exemplo[1]. Fatores como temperatura e duração do tratamento térmico ou tipo de calor (úmido ou seco) interferem na suscetibilidade térmica do micro organismo.
É esperado que conforme se aumente a temperatura, menos tempo seja necessário para a eliminação do microrganismos. O calor úmido apresenta um maior poder de penetração no objeto a ser esterilizado, entretanto há situações na qual o calor seco pode realizar o processo mais rapidamente[30].
Outros fatores como composição estrutural ou concentração de certos compostos afetam a forma como o micro organismo interagem com o calor. Estruturas como endósporos, por não possuírem muita água em suas células, são altamente resistentes ao calor, fazendo com que a esterilização de materiais secos seja mais difícil, devido a necessidade de exposição a maiores temperaturas e por mais tempo. Enquanto açúcares, proteínas e gorduras dificultam a penetração do calor, altas concentrações de sais também influenciam na interação calor/microrganismo, aumentando ou diminuindo sua resistência ao calor.
Autoclave e pasteurização
A autoclave é um dispositivo que permite o vapor d’água chagar a temperaturas superiores a 100 ºC aumentando a pressão do meio. Seu uso é recomendado para endósporos, que precisam de exposição a 121ºC por cerca de 15 min, para garantir sua morte (para objetos pequenos).
Enquanto o autoclave é um processo mais agressivo de esterilização e utilizado para esterilizar objetos sólidos, ela é inviável para certos casos, como tratamento de produtos alimentícios em geral. Um outro processo de controle de microrganismos é a pasteurização nesse processo os líquidos são elevados a uma temperatura específica que reduz o número de microrganismos. Apesar de não eliminar completamente todos os seres vivos, devido a redução do número total de organismos presente, a sua proliferação é retardada, o que prolonga a vida útil desses produtos. A pasteurização é utilizada majoritariamente em produtos alimentícios, pois os outros processos de esterilização poderiam alterar o sabor do produto final[1].
Controle Físico por Radiação
A esterilização por radiação depende de uma série de fatores, sendo eles o comprimento de onda, a intensidade, a distância da fonte e o tempo de exposição. Radiação, como raio X, raio ultravioleta (UV), bem como partículas carregadas (partículas alfa e beta) também constituem um agente capaz de controlar o crescimento microbiano. Esse controle ocorre ao se incidir radiação sobre o material a ser esterilizado de modo a destruir a microbiota local. Essa destruição é decorrente da transferência direta ou indireta de energia, que depende de vários fatores, entre eles energia do feixe, número atômico do material e principalmente do tipo da radiação.[1]
A radiação pode ser classificada em dois tipos, ambas com potencial de controlar o crescimento microbiano. A primeira é a radiação ionizante, uma radiação eletromagnética (campos elétricos e magnéticos oscilantes no espaço) com energia suficiente para “ejetar” um elétron do átomo de um material. Este elétron, por ser uma partícula carregada, interage com a matéria através de ionizações e colisões, trocando momento e carga com o meio. Quando este elétron interage diretamente com a membrana de DNA da célula, se fala em dano direto, bloqueando a duplicação de NA e paralisando a síntese proteica. Quando o elétron, por outro lado, interage com o meio intracelular (para patógenos como bactérias, protozoários e fungos) ele pode produzir radicais livres. Estes radicais se tratam de espécies muito reativas que podem danificar macromoléculas.[1]
Os principais radicais livres são os radicais hidroxila (OH) e hidreto (H), oriundos da radiólise (quebra) da molécula de água, principal componente do meio intracelular das células.[1] Existem também radiações não-ionizantes, como por exemplo, os raios UV, que não tem energia suficiente para ionizar os elétrons do meio. A radiação UV de comprimento de onda entre 220 e 300 nm, no entanto, pode ser absorvida pelo DNA alterando seu estado de energia, induzindo rotações e torções em meio viscoso. Esses movimentos podem causar quebra na molécula que, se não for devidamente reparado, pode se perpetuar levando a mutações, podendo levar à morte do organismo exposto. Para a maior parte dos compostos biológicos, a radiação UV tem baixo poder de penetração, sendo utilizada para descontaminar e desinfetar superfícies expostas ou ar, como visto em hospitais e salas de preparação de alimentos, geralmente é utilizada em alimentos já embalados.[1]
A radiação ionizante, por ter mais energia, tende a penetrar mais na matéria já que tem o comprimento de onda entre 0,1-40 nm, sendo suficiente para matar os microrganismos em itens volumosos, como produtos alimentícios e suprimentos médicos, fármacos e até mesmo tecidos para enxertos, tendo a aprovação do FDA (“Food and Drug Administration”), nos Estados Unidos. (Madigan et al, 2016).[1] Seja ionizante ou não ionizante, natural (como produtos do decaimento de radionuclídeos) ou artificial (emitida por tubos de raios X) a radiação pode ser quantificada em termos de várias grandezas. Para aplicações biológicas como a esterilização usa-se por padrão, a grandeza “dose absorvida”, isto é, a energia depositada pela radiação por unidade de massa no material. A unidade de dose absorvida é o Gray (energia [J] / unidade de massa [kg].[1]
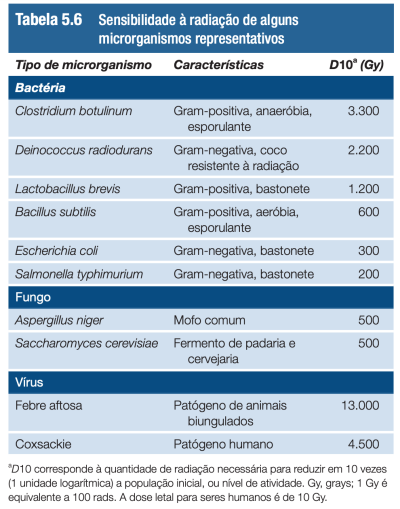
As doses de radiação empregadas para o controle do crescimento de microrganismos são muito maiores do que as utilizadas em aplicações médicas, por exemplo, em radioterapia. Isso ocorre porque micro-organismos são muito mais resistentes à radiação do que macro-organismos, como mamíferos, por exemplo. (Okuno & Yoshimura, 2010).[33] Tendo menos células, o alvo para interação da radiação é reduzido proporcionalmente, de modo que é necessário expor matérias a altíssima dose para que a radiação controle a microbiota local. Por exemplo, a dose de radiação para reduzir uma cultura de Clostridium botulinum a um décimo do valor inicial (D10), é 3300 Gy, sendo que uma dose de 10 Gy já pode ser letal aos seres humanos se utilizada por um curto período de tempo.[1]
Por se tratar, também, de energia em trânsito, o tratamento por radiação é semelhante ao tratamento por calor. Em ambos os casos, a destruição dos endósporos com radiação ionizante é mais difícil do que a de células vegetativas, e os vírus são mais difíceis de serem destruídos do que as bactérias (Madigan et al, 2016). Essa semelhança pode ser vista ao comparar a curva de morte da radiação ionizante com a análoga para a esterilização por calor.[1]
Esterilização por filtração
Apesar do calor ser uma forma eficaz de esterilização da maioria dos líquidos, a esterilização por filtração pode ser utilizada em gases e líquidos sensíveis ao calor. Nesse método o líquido ou gás passa por um filtro com poros de diâmetro muito pequeno (cerca de 0,2 micrometro) que limitam a passagem de qualquer célula que esteja presente, os filtros podem ser composto de celulose, acetato, policarbonatos entre outros. Porém não impedem a passagem da maioria dos vírus. São vários tipos de filtros disponíveis para uso na microbiologia como filtros de profundidade, membranas filtrantes e filtros nucleoporos.[1]
Os filtros de profundidade são formados por uma lâmina ou camada fibrosa confeccionada por um conjunto de fibras de papel ou borossilicato (vidro) sobrepostas. Eles são importantes para fins de biossegurança. Por exemplo, são utilizados nas manipulações celulares, culturas microbianas e meios de cultura, pois requerem a minimização de contaminação tanto do manipulador como como dos materiais experimentais. Essas manipulações podem ser realizadas de maneira eficiente com o uso de um filtro de profundidade denominado HEPA (filtro de alta eficiência para ar particulado, em inglês) que geralmente removem partículas-teste de 0,3 micrometro com eficiência maior que 99,9%.[1]
As membranas filtrantes são o tipo mais comum de filtros utilizados para esterilização de líquidos na microbiologia. São compostas por polímeros que suportam altas tensões, como acetato de celulose ou polissulfon, e apresentam inúmeros diminutos poros. A filtração é realizada com auxílio de uma seringa, compressor ou bomba de vácuo, para a passagem do aparato de filtração até um recipiente coletor estéril. Outro tipo de membrana para filtração é o filtro nucleocporo. Confeccionado por filmes com espessura de 10 micrômetros de policarbonato tratado com radiação e cauterizados com produto químico, são utilizados no isolamento de espécimes para microscopia eletrônica de varredura e ao concentrá-los no filtro permitem a sua visualização ao microscópio.[1]
Membranas filtrantes. Unidades de membranas filtrantes descartáveis, pré-esterilizadas e montadas. Na esquerda: um sistema de filtração de pequenos volumes. Na direita: um sistema de filtração de volumes maiores.
Controle químico do crescimento
É possível controlar o crescimento microbiano através de métodos físicos ou químicos. Para que seja denominado agente antimicrobiano, um composto, podendo ser de origem natural, sintético ou químico deve inibir ou matar o crescimento do microorganismo. É importante ressaltar que são poucos os agentes químicos que realizam a esterificação, sendo em sua grande maioria apenas redutores de populações microbianas em níveis seguros ou removem as formas vegetativas de patógenos. Os antimicrobianos químicos também geralmente requerem maior tempo de exposição para que possam afetar os microorganismos ou endósporos mais resistentes. Agentes que matam organismos são associados ao prefixo -cidas, como por exemplo, bactericidas, fungicidas e viricidas, já os agentes que apenas inibem o crescimento são associados ao prefixo -státicos, como por exemplo, bacteriostáticos, fungistáticos e viristaticos. Podemos classificar os agentes antimicrobianos como:
Bacteriostáticos: são geralmente inibidores de algum processo químico importante, sendo que suas ligações são relativamente fracas, sendo que se removido, as células podem crescer novamente, como por exemplo, antibióticos.
Bactericidas: são o contrário dos agentes bacteriostáticos e ligam-se fortemente com a célula, e consequentemente acabam matando-as. Entretanto as células mortas não são lisadas o que reflete na turbidez da cultura, mantendo-se constante. Um exemplo desse agente são os formaldeídos.
Bacteriolíticos: estes agentes matam as células devido a lise e liberação de conteúdo citoplasmático. Um exemplo desses agentes pode ser o detergente, que danifica a membrana citoplasmática.[1]
Os métodos químicos de controle do crescimento microbiano são:
- Conservantes químicos de alimentos são adicionados aos alimentos para retardar sua deterioração, por exemplo o ácido sórbico
Agentes químicos antimicrobianos
São denominados agentes antimicrobianos os agentes químicos que tem como função a inibição do crescimento de microrganismos, sendo utilizados para impedir o crescimento de patógenos humanos na superfície de seus corpos ou em objetos inanimados, esterilizantes, desinfetantes, sanitizantes e antissépticos.
Esterilizantes: os esterilizantes matam todas as formas de vidas microbianas, e são muito utilizados para descontaminar materiais sensíveis ao calor.
Desinfetantes: os desinfetantes são geralmente utilizados em objetos inanimados, são importes no controle de infecções em hospitais e outros ambientes médicos.
Sanitizantes: são produtos químicos menos agressivos que desinfetantes, sendo agentes que reduzem o número de microrganismos, mas não necessariamente esterilizam o objeto.
Antissépticos: frequentemente chamados de germicidas, são agentes químicos que matam ou inibem o crescimento de microrganismos, sendo atóxicos o suficiente para serem usados em tecidos vivos.
São vários os fatores que podem afetar a eficiência dos agentes antimicrobianos químicos, visto que as bactérias frequentemente formam biofilmes, revestindo os tecidos superficiais, sendo que esses biofilmes podem retardar e até mesmo inibir totalmente a penetração dos agentes químicos.[1]
Mecanismos de ação:
Os agentes antimicrobianos possuem diferentes classificações quanto ao lugar em que agem.
Parede celular: a penicilina é um agente antimicrobiano onde sua função de atuação e inibição do microrganismo é na síntese da parede celular.
Membrana plasmática: a polimixina B. tem como função alterar a permeabilidade da membrana plasmática do microrganismo, assim afetando seus processos osmóticos.
Material genético: a novobiocina é o agente antimicrobiano na qual interfere na replicação do DNA.
Proteínas: os agentes antimicrobianos interferem na síntese proteica, podendo ser de forma reversível (cloranfenicol) ou irreversível (estreptomicina).[34]
As plantas como habitats microbianos
A interação entre plantas e microrganismos pode ocorrer de diversas maneiras desde diretamente em suas raízes e na superfície de suas folhas até no interior de seus tecidos vasculares e células. De modo geral, grande parte das interações de mutualismos entre microrganismos e plantas resultam tanto em um aumento da disponibilidade de nutrientes para as plantas como, também, na proteção contra patógenos. [35].
A simbiose do nódulo radicular das leguminosas
O mutualismo que ocorre entre plantas leguminosas e bactérias fixadoras de nitrogênio é uma das mais importantes para o homem. Na grande família das leguminosas inclui-se plantas de grande importância agrícola, como soja, alfafa, feijões, trevo e ervilhas. Tais plantas são essenciais para a indústria agrícola e alimentícia, haja vista que substituem o uso de fertilizantes nitrogenados ocasionando grande economia aos fazendeiros, além de reduzir os efeitos poluentes causados pelo escoamento de fertilizantes.[36]
Os rizóbios, nome que deriva do principal gênero dessas bactérias rhizobium, são bactérias responsáveis pela fixação biológica de nitrogênio por meio de uma relação de simbiose com a planta. Os componentes da simbiose são denominados simbiontes. Tais bactérias são capazes de crescer livremente ou infectar as plantas leguminosas ocasionando uma relação de simbiose.
Na região das raízes das leguminosas infectadas pela bactéria rizóbio ocorre-se a formação de nódulos radiculares onde a bactéria fixa o nitrogênio gasoso. Vale ressaltar a grande importância na agricultura a fixação de nitrogênio no solo, pois a fixação de nitrogênio nos nódulos radiculares representa um quarto de todo nitrogênio fixado anualmente na terra.
Etapas de formação do nódulo radicular:
A formação do nódulo radicular constitui de seis etapas:(MADIGAN,2014,p.674) [37].
- Reconhecimento do parceiro correto por parte tanto da planta quanto da bactéria e ligação da bactéria aos pelos radiculares.
- Secreção de moléculas de oligossacarídeos sinalizadores (fatores de nodulação) pela bactéria.
- Invasão do radicular pela bactéria.
- Migração da bactéria para a raiz principal por meio do conduto infecção.
- Formação de células bacterianas modificadas (bacteroides) no interior das células vegetais e no desenvolvimento do estado fixador de nitrogênio.
- Divisão continuada da planta e da bactéria, formando o nódulo radicular maduro.
Outra maneira de ocorrer a formação dos nódulos radiculares acontecem com algumas espécies de rizóbios fototrópicos através da produção de citocininas, porém, tal mecanismo ainda não foi completamente explicado.
Ver Também
Ligações Externas
- https://portaldeinformacoes.conab.gov.br/safras?view=default - Dados sobre produções agrícolas podem ser encontrados no portal da CONAB.
- e-scola - Crescimentos Microbiano - Visitado em 03/07/2020
- Wikipédia, a enciclopédia livre - Descrição da proteína Actina - Visitado
em 24/06/2020.
- Wikipédia, a enciclopédia livre - Descrição de peptidoglicano - Visitado em 25/06/2020.
- qwerty.wiki - Citoesqueleto Procariótico - Visitado em 03/07/2020
- https://pt.wikipedia.org/wiki/Super%C3%B3xido. - Radical Super óxido - Visitado em 25/06/2020.