Tabela de conteúdos
Enzimologia
Enzimologia derivada do grego zýme(fermento) e logia(estudo) é o ramo da bioquímica que estuda substâncias orgânicas normalmente compostas por proteínas que apresentam umas das principais funções de atividades intracelulares e extracelulares, ser um catalisador para reações químicas, mais conhecidas como enzimas. Muitos dos sistemas vivos são formados a partir de uma grande variedade dessas reações bioquímicas, que em sua grande maioria são mediadas por enzimas[1].
As enzimas são consideradas catalisadoras pois facilitam a reação entre os reagentes através da diminuição da energia de ativação das reações químicas, resultando em um aumento significativo na velocidade de reação. Sem as enzimas, muitas das reações bioquímicas seriam extremamente lentas, sendo não suficientemente altas para satisfazer as demandas metabólicas das células e manutenção de seres vivos. Então por definição podemos dizer que uma das principais funções das enzimas é aumentar a velocidade de reações químicas para o metabolismo de seres vivos.
O estudos sobre enzimas se deu no fim do século XVII e início do século XVIII, com conceitos simples de como era feito o processo de digestão de alimentos, entre outros processos básico de digestão, porém, não se sabia o motivos. Somente no século XIX, elas foram de fato descobertas por Louis Pasteur (1822~1895) e assim começaram as classificações. Descobriu-se que em grande parte das células vivas elas estavam presentes e são de extrema importância para processos metabólico.

Não só para a ciência essa descoberta foi importante, mas também, para a indústria alimentícia e farmacêutica, isso facilitou o processamento de alimentos e remédios de uma maneira muito mais eficiente e rápida.
Em 1878, Wilhelm Kuhne[2] definiu o termo “enzimas”, que futuramente passou a ser usado para proteínas com capacidade de catalisador.
Em 1897, Eduard Buchner[3] entendeu que os extratos de levedo e os processos químicos envolvidos pela enzimas presentes continuavam a funcionar mesmo com ausência de células vivas (fato importante para indústria).
Nos dias atuais os estudos de enzimas ainda continua mas em um nível quântico, devido a melhorias da tecnologia ao longos dos anos[4].
Características
Mediadoras de processos bioquímicos essenciais à vida humana
O corpo humano depende de uma série de reações químicas para que ocorra a manutenção da vida, porém, o pH próximo de 7,0 e a temperatura em torno de 36 graus Celsius, não são condições favoráveis ao desenvolvimento de todas reações. Reações que necessitam de altas temperaturas e baixos valores de pH, como por exemplo a quebra das proteínas em nosso sistema digestório, não ocorreriam facilmente em nosso sistema, todavia elas ocorrem graças às enzimas [5].
No estômago, ocorre a liberação de enzimas pepsina, juntamente com outros produtos que caracterizam o suco gástrico. O estômago então realiza movimentos peristálticos para a mistura do bolo alimentar com o suco gástrico para a atuação da pepsina, que permite a conversão de proteínas em polipeptídeos e aminoácidos [1].
Já no intestino delgado, são liberadas uma série de enzimas (como a tripsina que transforma proteínas em aminoácidos; amilase que transforma amido e dextrina em maltose; a maltase que transforma maltose em glicose e a lipase pancreática que transforma gordura em ácidos graxos e glicerina, dentre outras). Após isso, é liberada a bílis pelo fígado que facilita a digestão diluindo o conteúdo intestinal. Após concluída a digestão intestinal, muito devido às ações das enzimas, a massa alimentar fica reduzida a uma pasta formada por água, glicose, glicerina, aminoácidos e sais minerais, todos prontos para serem absorvidos [6].
Nomenclatura e Especificidade
A absoluta especificidade que algumas enzimas exibem, é uma das características que faz com que seu diagnostico seja importante. Ou seja, algumas enzimas irão catalizar uma reação particular enquanto outras podem ser especificas para um tipo de ligação química ou grupo funcional. Esses tipos de especificidade são classificados em quatro grupos[7]:
1. Especificidade absoluta: a enzima catalise uma unica reação [7].
2. Especificidade de Grupo: a enzima ira agir somente em moléculas com um grupo funcional especifico (ex: grupos amino, fosfato e metil)[7].
3. Especificidade de ligação: a enzima ira agir em um tipo particular de ligação química, independente do resto da estrutura molecular[7].
4. Especificidade Estereoquímica: a enzima ira agir em um grupo esteroide ou isômero óptico[7].
A denominação de cada enzima pode ser dado de acordo com a reação química no qual ocorrem a catálise ou em relação ao substrato em que se ligam, acrescentando-se o sufixo “-ase”, como é o exemplo da enzima “lipase” que atua sobre os lipídeos. Porém, ao longo da história nem todas enzimas seguiram essa regra, como é o caso da ptialina, a enzima localizada na saliva que participa do início da digestão do amido consumido [6].
São classificadas em 6 grupos diferentes, separadas de acordo com o tipo de reação química que participam [8]:
1. Transferases: Como diz o nome, em reações com transferência de grupos funcionais (Ex: Quniases)[8].
2. Isomerases: Faz a mediação na conversão de substancias isoméricas óticos ou geométricos (Ex: Epimeraes)[8].
3. Hidrolases: Reações de hidrólise com ligações covalentes (Ex: Peptidases)[8].
4. Liases: Remoção de moléculas da água, amônia e gás carbônico, rompendo ligações covalentes deixando ligações duplas ou anéis ou inversamente adicionando grupos a essas ligações duplas. (Ex: Descarboxilase)[8].
5. Ligases: Forma novas moléculas, a partir de duas já existentes com a hidrolise de uma ligação difosfato em ATP ou trifosfato similar (Ex: Sintetases)[8].
6. Oxido-redutases: Realizam catálise em transferência de elétrons ou reações de oxido-redução (Ex: Oxidase)[8].
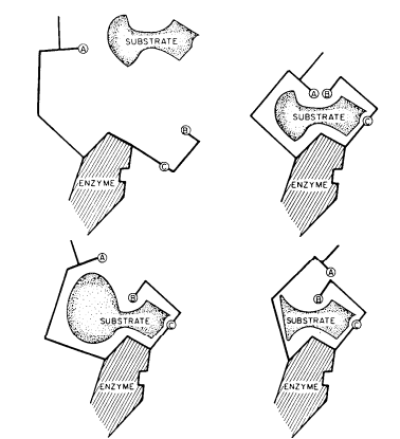
Diante disto, vale ressaltar a hipótese de “Chave e Fechadura”, que afirma que a enzima (fechadura) e o substrato (chave) são tão especificas, tendo apenas um tipo de enzima para cada fase que o substrato passa. A especificidade enzimática é resultado das interações não covalentes entre a enzima e o substrato. A identificação dos aminoácidos do sitio ativo se relaciona com a transição dos substratos. Existem experimentos de mutuação sitio-dirigida e cinética que são responsáveis por fornecer dados da especificidade molecular. Segundo Emil Fischer, o encaixe facilita a modificação do substrato por parte da enzima, contudo, após ter realizado sua função, a mesma se solta do substrato tornando-se disponível novamente[9].
As enzimas são substâncias de estrutura globular tridimensional, que podem ser encontradas em quase todas as estruturas celulares. Elas fazem parte do grupo das proteínas e são compostas por longas cadeias lineares de aminoácidos, esta parte é denominada apoenzima, além disso, muitas enzimas possuem uma parte não-proteica em sua estrutura, chamada de co-fator. [10]
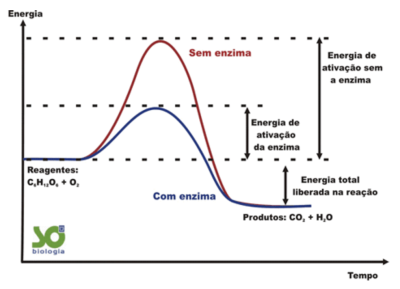
A principal função das enzimas é agir como catalisador no processo de reações químicas. Catalisar significa acelerar um processo, fazendo com que o tempo de reação seja menor, e no caso das enzimas, elas executam esta função provocando a diminuição da energia de ativação das reações, ou seja, a quantidade de energia que será necessária para que a reação aconteça, e tendo assim uma maior conversão de moléculas com a presença dessa enzima, conforme esquematizado no gráfico ao lado.
Esse ganho na velocidade pode chegar na proporção de 10 elevado a 17 se comparado com a reação sem as mesmas.
A catálise inicia-se no momento em que se a enzima se liga ao substrato reagente. Essa ligação ocorre em uma região da enzima denominada sitio ativo, o substrato necessita ter a forma espacial adequada, para se alojar neste local e, grupos químicos ideais para realizar as ligações com os radicais, ademais, é necessária a inclusão de uma certa quantidade de energia no processo, comumente, na forma de calor para que a reação ocorra.[7]
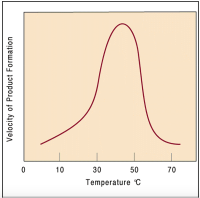
Uma característica importante deste processo, para garantir que ocorra da melhor maneira, é a temperatura. Pois, sempre há um valor ideal em que a eficiência da reação será mais alta e próxima do ideal. Por exemplo, nos animais homeotérmicos esta temperatura ideal está entre 35ºC e 40ºC, conforme indicado no gráfico abaixo. Portanto, partindo de temperaturas baixas, conforme haja aumento, a velocidade das reações também aumentam até o ponto de temperatura ideal. Mas, ao ocorrer um aumento além deste ponto, a velocidade tende a diminuir, pois as enzimas começam a sofrer desnaturação, perdendo a conformação espacial e por fim dificultando o encaixe do substrato[13].
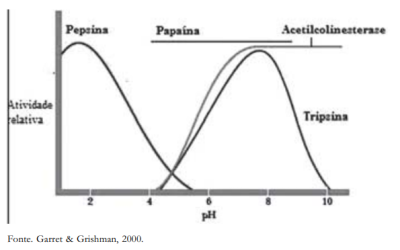
Outro fator que pode influenciar na velocidade da reação é o potencial hidrogeniônico (pH), onde a enzima se encontra e, tendo o ponto de pH ideal, como sendo o ponto onde a enzima esta mais ativa. Por exemplo: a enzima Tripsina tem alta velocidade de reação a um pH 6, e a Fosfatase alcalina a 9. Contudo, em uma solução de pH 2 que é a ideal para a Pepsina a maioria das enzimas seriam desnaturadas. O pH também pode alternar as cargas de um sitio ativo ou até mesmo a própria configuração da proteína[7].
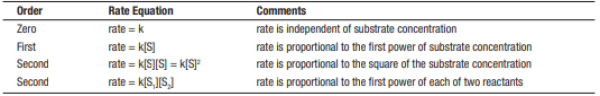
Por fim, outra característica que influencia o desempenho enzimático é a própria concentração de enzimas. A quantidade de enzimas é medida pela atividade enzimática das mesmas. Qualquer mudança na quantidade de produto formado, em um determinado tempo, será dependente do nível de enzimas presentes. A essas reações se da o nome de Ordem Zero. Nessas reações, as taxas de formação desse produto, não dependem da concentração do substrato e são iguais a uma constante k [8].
Conforme a tabela abaixo, podemos notar que, a equação da taxa de Ordem Zero não depende da concentração da substância. Para reação de primeira ordem, a taxa é proporcional a primeira potência da concentração do substrato, já as de segunda ordem, a taxa é proporcional ao quadrado da concentração da substância. Para mais de um reagente, a taxa é proporcional a primeira potência de cada um dos reagentes presentes. Quanto maior a quantidade, mais rápida será a velocidade de reação , pois, o produto será consumido em menor tempo. Contudo, quando se aumenta a concentração de substrato, a velocidade tende a um limite de acordo com a quantidade de enzimas[8].
Inibição enzimática
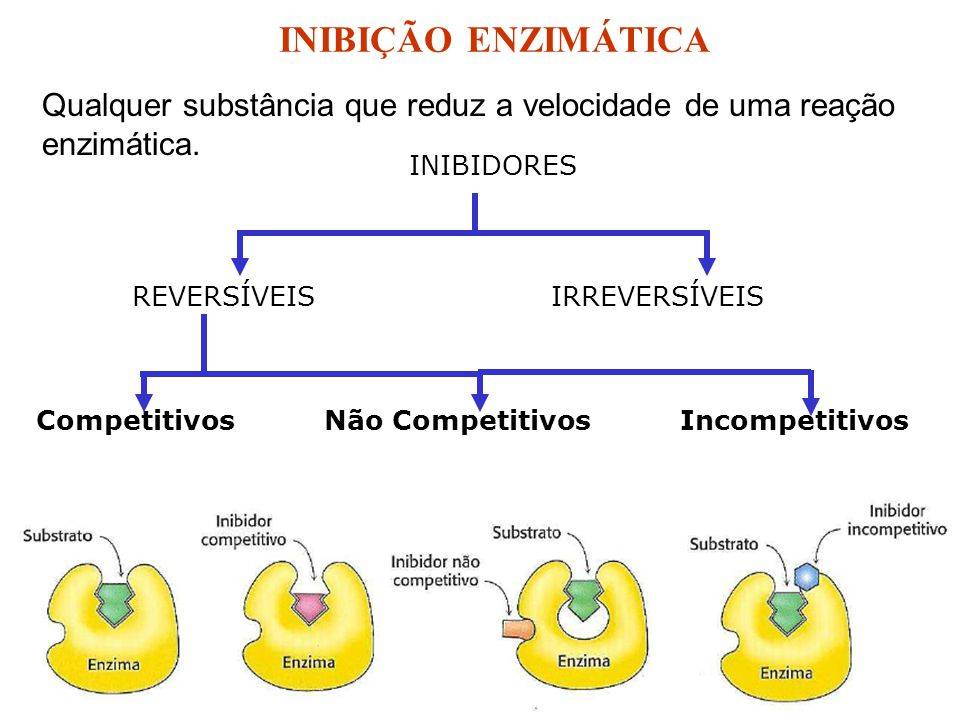
Outra característica das enzimas é que, as reações bioquímicas por elas catalisadas podem ser controladas ou até mesmo inibidas através de inibidores enzimáticos. Determinadas substâncias se associam as enzimas alterando sua atividade enzimática através da atuação na ligação da enzima com o substrato. Isso faz com que a energia de ativação diminua pouco, resultando em um não cumprimento de seu papel por parte da enzima. Dentre os principais tipos de inibidores, estão [14]:
Inibição reversível: o inibidor se liga com a enzima através de uma ligação não covalente. Após serem dissociados, a enzima retorna a sua atividade[15].
Inibição reversível competitiva: moléculas competem com o substrato normal e são caracterizadas estruturalmente semelhantes a esse substrato[15].
Inibição reversível não competitiva: inibidor não necessita se assemelhar ao substrato, e provoca uma distorção no sítio ativo da enzima. Se liga diretamente no substrato, e não à enzima livre[15].
Inibição irreversível: substâncias se ligam covalentemente às enzimas, tornando-as inativas. São inibidores extremamente seletivos e modificam a enzima de forma molecular[15].
Termodinâmica
Introdução
Associada aos fenômenos de temperatura, calor e pressão, a termodinâmica é a ciência que estuda a relação e as propriedades de transferência de energia por um sistema ou entre dois ou mais corpos, ou seja, é a parte da física que averígua a associação de energia térmica (calor) e energia mecânica (trabalho). No contexto biológico, por exemplo, a termodinâmica possui suma importância para explicar o comportamento de enzimas, isto é, para esclarecer como ocorre a conversão de reagentes em produtos que está diretamente relacionada à energia necessária de ativação da reação[17].
As enzimas são catalisadores biológicos produzidos pelas células e possuem, por sua vez, capacidade de acelerar uma reação, o processo que envolve a presença de um catalisador é chamado de catálise. Atuam em pequenas concentrações e não alteram o equilíbrio químico da reação, ou seja, a concentração de reagentes e produtos no final da reação são as mesmas da reação não catalisada[18].
O funcionamento das enzimas se deve à energia livre de ativação, que é a energia inicial necessária para que ocorra o rompimento da configuração estável da molécula e, ao ,estado de transição onde se localiza o nível máximo de energia na reação, ocorre a separação de reagentes em produtos e é, por sua vez, altamente instável. A aceleração da velocidade da reação, realizado pelas enzimas, é devido à diminuição da energia livre de ativação da mesma, sem que ocorra alterações termodinâmicas[19].
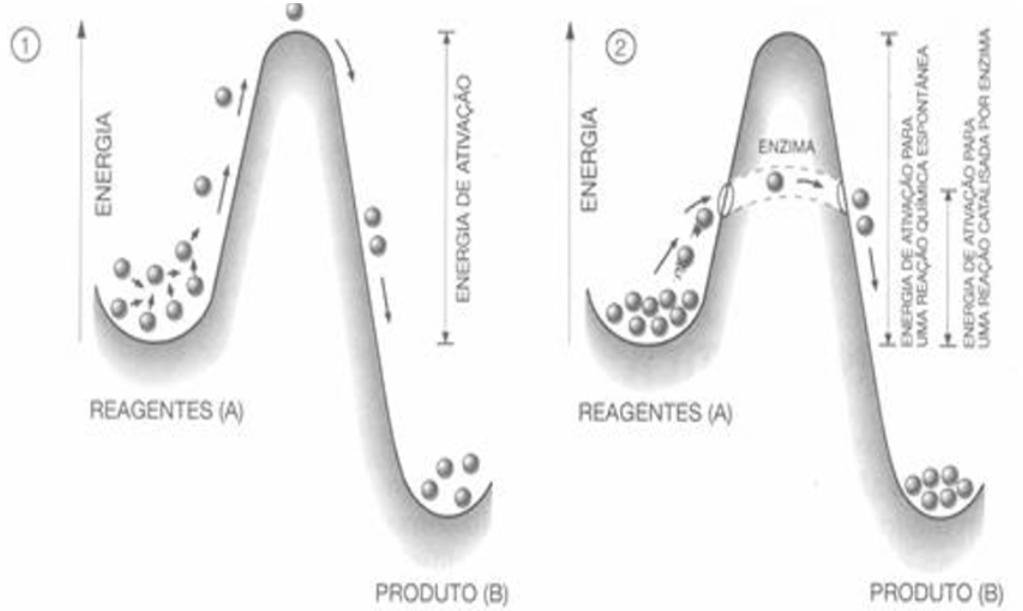
As enzimas atuam de maneira ordenada de modo que substratos específicos se conectam às enzimas em locais específicos onde, ao fim de cada reação são liberadas para que possam se recompor e serem utilizadas em novas reações[21]. Essas, podem ser divididas em:g6 reações exergônicas (catabolismo) e reações endergônicas (anabolismo). A primeira é conhecida por ser uma reação termodinamicamente favorável, ou seja, reação que libera energia para a síntese de outras moléculas, para realizar trabalho ou ser emitida na forma de calor[22].

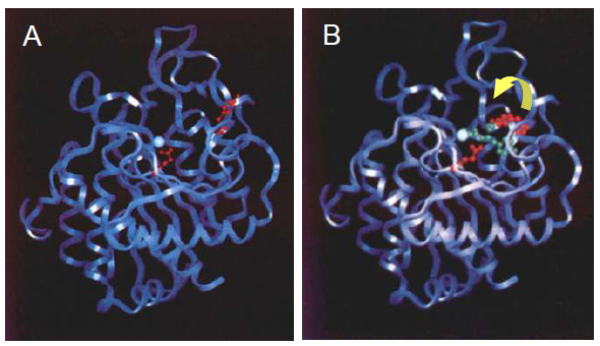
Diante disso, sabendo que no modelo do encaixe induzido a formação de ligações covalentes determinam a especificidade para o ES encontrado no sítio ativo (catálico) presente na enzima, e que a própria ligação do substrato incita a formação desse local em específico, através da mudança na organização molecular, o modelo de encaixe induzido pode ser mostrado pela Carbopeptidase, pela figura a seguir. Temos em A, na figura, que a enzima apresenta um sítio catálitico formado pelos resíduos de Tyr 248 e por Glu 270, em vermelho um acima e outro no centro, e também pelo átomo de zinco (Zn2+), em azul. Já na parte B da figura, há uma grande mudança conformacional ao redor do sítio ativo da “carboxipeptidase A” ocasionada pela ligação do substrato dipeptídico glicil-L-tirosina, apresentado em verde.
Componentes da Ação Enzimática
E + S ↔ ES ↔ E + P
E = Enzima
S = Substrato
ES = Complexo enzima- substrato (Estado de transição)
P = Produto
Sítio Catalítico ou Centro ativo é a região da molécula enzimática, onde ocorre a reação com o substrato. Sua estrutura é formada pelos grupos de partes de sequência de aminoácidos[4].
Além disso, as enzimas são específicas para determinados substratos, ou seja, existe uma relação de complementaridade entre a enzima e o respectivo substrato. Algumas enzimas ligam-se apenas a um tipo de substrato catalisando uma única reação – especificidade absoluta. Outras enzimas ligam-se a diferentes substratos quimicamente semelhantes, catalisando consequentemente várias reações – especificidade relativa[24].
Ligação da Enzima ao Substrato
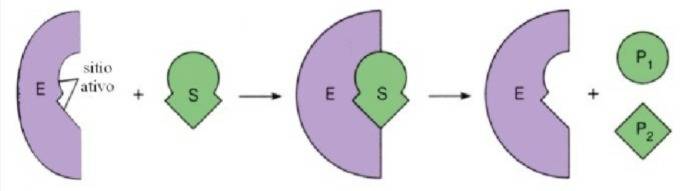
Chave - Fechadura
O modelo chave- fechadura, proposto por Hermann Emil Fischer em 1894, considerava o perfeito encaixe do substrato (chave) ao sítio catalítico da enzima (fechadura), logo a especificidade se dá através da enzima que tem um formato complementar ao seu substrato, não podendo ocorrer nenhuma flexibilidade entre os envolvidos. Porém, pesquisas sugerem que pode ocorrer uma mudança conformacional na enzima, de modo que esta possa se adaptar ao substrato, o que contradiz o modelo tão difundido da “chave-fechadura”[25].
Encaixe Induzido
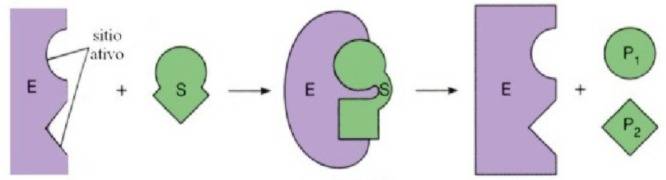
Em 1958, Daniel E.Koshland apresentou um novo modelo de encaixe da enzima ao substrato (encaixe induzido), que defende a alteração da conformação da enzima ao substrato. No modelo, o sítio ativo não apresenta uma forma rígida, sua estrutura é de um arranjo espacial preciso e específico dos grupos R dos aminoácidos do sítio ativo das enzimas. Assim sendo, ocorre uma indução para que haja mudanças que permitam o reconhecimento do substrato. Além disso, a modificação gerada na enzima pode ser passada para enzimas próximas, o que garante a eficiência do processo. Agora nessa nova visão, a interação entre a enzima e o substrato não é um processo rígido e inflexível, temos demonstrada a capacidade da enzima de se adaptar ao substrato, fato que era impossível no modelo chave-fechadura[25].
A teoria do encaixe induzido (Induced Fit theory) é estabelecida nos seguintes termos:
I) é necessária a orientação precisa dos grupos catalíticos para a ação enzimática ocorrer;
II) o substrato causa uma mudança significativa na relação tridimensional dos aminoácidos no local ativo;
III) As alterações na estrutura da proteína causadas pelo substrato irão deslocar os grupos catalíticos para o seu devido alinhamento, enquanto um não substrato não conseguirá;
Daniel Koshland mostrou que a especificidade de uma enzima não se deve à existência de um local de ligação rígido para o substrato, pelo contrário, um detalhe importante da especificidade enzimática consiste na presença de um local de ligação que há uma resposta flexível na presença de um substrato; somente quando o último está presente, o local de ligação assume a estrutura adequada para a formação de um complexo reativo enzima-substrato. O modelo de adaptação induzido é a base do modelo de interação sequencial de enzimas alostéricas, um modelo na qual baseia em duas hipóteses principais:
(a) na ausência de um ligante, a proteína alostérica existe em apenas uma conformação;
(b) a ligação do ligante a uma sub-unidade produz uma alteração conformacional da própria subunidade, e essa alteração, por sua vez, altera a conformação das sub-unidades livres adjacentes (efeito cooperativo).
Deve ocorrer o alinhamento dos grupos catalíticos e os grupos de ligação devem ser otimizados para o estado de transição. Quando a enzima possui pequenas movimentações necessárias para que ocorra a catálise, que é gerado pela ligação com o substrato, a ação enzimática ocorre. Essas teorias são de extrema importância para a análise do aumento de cepas de organismos resistentes a determinados medicamentos. Além do mais, por a enzima assumir uma forma flexível permite a ligação a um local “regulatório” ou “alostérico”, que pode ser uma alternativa mais eficiente para terapia de medicamentos. A descoberta de que pequenas alterações podem “ativar” ou “desativar” uma enzima é muito promissor.
Diante disso, sabendo que no modelo do encaixe induzido a formação de ligações covalentes determinam a especificidade para o ES encontrado no sítio ativo (catalítico) presente na enzima, e que a própria ligação do substrato incita a formação desse local em específico, através da mudança na organização molecular, o modelo de encaixe induzido pode ser mostrado pela Carbopeptidase, pela figura a seguir.
Temos em A, na figura, que a enzima apresenta um sítio catálitico formado pelos resíduos de Tyr 248 e por Glu 270, em vermelho um acima e outro no centro, e também pelo átomo de zinco (Zn2+), em azul. Já na parte B da figura, há uma grande mudança conformacional ao redor do sítio ativo da “carboxipeptidase A” ocasionada pela ligação do substrato dipeptídico glicil-L-tirosina, apresentado em verde.
Fatores que Influenciam a Ação Enzimática
Fatores externos
pH
O pH de uma enzima é denominado ótimo quando sua atividade catalítica é máxima. A enzima tem sua atividade de reação afetada (reduzida) quando possui valor de pH variando em torno do seu pH ótimo e pode sofrer desnaturação quando essas variações de valores de pH é considerada brusca, ou seja, a enzima perde sua atividade biológica[28].
A tabela e a figura abaixo mostram os valores de pH ótimo de algumas enzimas[29].
Temperatura
Como na maioria das reações químicas, a velocidade das reações enzimáticas são afetadas pela temperatura. De acordo com estudos feitos por Worthington (2019), a reação de catalização de uma enzima torna-se mais rápida à medida que a temperatura aumenta, uma vez que a uma temperatura de 10ºC foi possível observar atividade de 50 a 100% das enzimas e, a uma temperatura relativamente baixa como, por exemplo, 1°C ou 2°C notou-se uma redução nas atividades enzimáticas para cerca de 10% a 20%[6]. Entretanto, é importante lembrar que após a temperatura ótima ser atingida a velocidade da reação será somente diminuída caso a temperatura continue aumentando, pois a agitação das moléculas será muito grande, a ponto das ligações que estabilizam a estrutura espacial da enzima se rompam e aconteça o processo de desnaturação. E para cada enzima existe um temperatura ótima, na qual a velocidade da reação é máxima. [31].
A enzima somente manterá sua atividade catalítica ativa quando a temperatura que a mesma se encontra estiver numa determinada faixa a qual a enzima é estável. Por exemplo, enzimas de bactérias termofílicas (que habitam fontes de água extremamente quentes), como a taq polimerase, apresentam atividade enzimática em temperaturas superiores a 85°C enquanto a ribonuclease perde sua atividade com o aquecimento, mas a recupera com o resfriamento[30].
Fatores que envolvem componentes da reação
- Mecanismo de ação enzimática
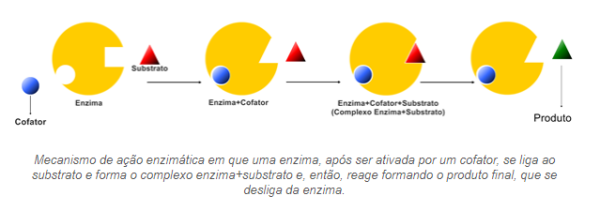
A concentração enzimática está intimamente relacionada com sua estrutura. Cada estrutura de enzima vai se ligar com um tipo específico de substrato. A atividade enzimática poderá ser ativada pela presença de outras moléculas genericamente chamadas cofatores, quando são íons inorgânicos e de coenzimas quando são moléculas orgânicas, como as vitaminas. Esses ativadores enzimáticos agem alterando a conformação proteica, de modo que o sítio ativo tenha afinidade pelo substrato a se ligar para a formação dos produtos, como mostrado na figura. É importante ressaltar que a enzima não promove a reação, ela apenas acelera uma reação que aconteceria naturalmente. [31]
- Concentração do substrato
Cada enzima apresenta uma forma e uma função específica, que será capaz de atuar sobre um determinado substrato. A ação da enzima varia também, de acordo com a concentração de substrato. Com o aumento da concentração do substrato, aumentará a velocidade enzimática. Porém, se houver aumentos significativos das concentrações do substrato, a velocidade enzimática, por sua vez, sofre pouca alteração. A concentração de substrato influencia na velocidade da reação até um ponto máximo, chamado ponto de saturação. Isso ocorre pois as enzimas demonstram o efeito de saturação por seus substratos. Essa saturação significa que todas as enzimas estão com seus sítios ativos ligados ao substrato, portanto, a partir desse ponto não importa o quanto seja aumentada a concentração do substrato, a curva da velocidade tenderá a aproximar-se de um máximo, sem que nunca seja alcançado[31].
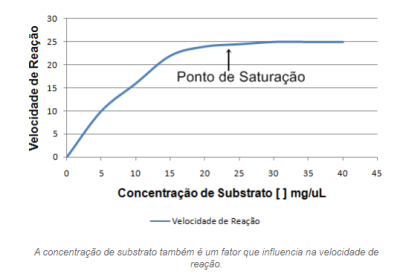
- Presença de Inibidores
As atividades das enzimas podem ser ajustadas com a presença de moléculas reguladoras que podem atuar como inibidores ou ativadores na função de diminuir ou aumentar, respectivamente, a proporção da atividade enzimática por diferentes formas. Os inibidores enzimáticos são substâncias que podem ocorrer naturalmente para definir diferentes momentos metabólicos no organismo, eles iram “competir” com o substrato pelo mesmo sítio ativo da enzima. Com isso, parte das moléculas enzimáticas presentes no meio se ligam nesses inibidores, não formando produto e impossibilitando o substrato de se ligar. Estes também podem ser usados como medicamentos para inibir enzimas que compõem problemas no organismo. Eles podem ser classificados em duas grandes categorias: reversíveis e irreversíveis [30].
INIBIDORES REVERSÍVEIS
Um inibidor reversível é aquele que se liga à enzima de forma reversível, ou seja, em um dado momento a enzima se desliga do inibidor e continua sua ação enzimática sem a presença dele. As ligações químicas do inibidor reversível à enzima ocorre através de interações químicas como, por exemplo: pontes de hidrogênio, van der Walls e interação hidrofóbica. Essa classificação de inibidor possui três tipos: competitiva, não competitiva e mista[32].
Inibição Reversível Competitiva
Tem como grande característica a estrutura do inibidor ser similar ao substrato que a enzima atua. Ao invés do substrato se ligar a enzima, quem se liga a ela é o inibidor e, uma vez ligada ao inibidor, o sítio ativo da enzima se torna incapaz de reagir com o substrato, produzindo um complexo enzima inibidor. A inibição competitiva pode ser revertida aumentando a concentração do substrato, uma vez que, a concentração de substrato permite a eles competir com o inibidor pela ligação com o sítio ativo da enzima. Um grande exemplo de inibidores competitivos é a álcool desidrogenase
que é uma enzima muito importante para o metabolismo do álcool no organismo. Sua principal função é eliminar a substância, quando presente no organismo [32].
Inibição Reversível Não Competitiva
A inibição não competitiva se caracteriza por não conter semelhança ao substrato da reação. O inibidor se liga à outras partes da enzima, como resíduos de aminoácidos (por exemplo hidroxilas, formando uma ação inespecífica) ou seja, uma vez que não há um reconhecimento específico entre sítio ativo e enzima, o inibidor atua em mais de uma enzima[15].
Inibição Reversível Incompetitiva
Na inibição incompetitiva, ou acompetitiva, a ligação do inibidor liga-se ao complexo Enzima-substrato e forma um complexo Enzima-substrato-inibidor. Este complexo é inativo, logo, o substrato não vai ser transformado pela enzima, com isso, a enzima não consegue gerar um produto[32].
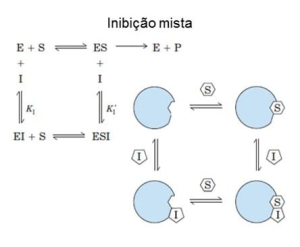
Inibição Reversível Mista
Na inibição mista, assim como em outros inibidores reversíveis, ocorre a interação da enzima de modo que tanto a ligação do substrato quanto a atividade catalítica é afetada [33]. Nesse caso, o inibidor se associa a uma região da enzima que seja diferente do sítio ativo. Nesse tipo de inibição, existe um sítio específico para o inibidor que, ao se ligarem à enzima, fazem com que ela se deforme de maneira que impeça o seu funcionamento. O inibidor pode se ligar tanto a enzima livre quanto ao complexo enzima-substrato, formando o complexo enzima substrato inibidor [32]. A ação enzimática dessa inibição pode ser vista na Figura 11, sendo que: E (enzima), S (Substrato), P (produto) e I (inibidor).
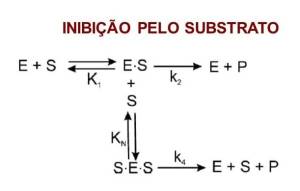
Inibição Por Substrato
Ocorre quando há uma concentração elevada de substrato em sua ação enzimática, dado que essa inibição é resultado da interação de duas moléculas de substrato com a enzima, o que acaba gerando um complexo (ESS) não produtivo [35].
.
INIBIDORES IRREVERSÍVEIS
Um inibidor irreversível é aquele que se liga a enzima inativando-a completamente. A enzima perde sua ação por completo e passa a depender apenas do inibidor. Esta categoria de inibidor ainda podem ser subdivididos em: competitivos e não-competitivos. Os inibidores irreversíveis reagem quimicamente com as enzimas formando permanentes ligações químicas de modo que, a enzima fica constantemente ligada aquele substrato e, com isso, perde toda sua função. Um exemplo de inibidores irreversíveis são os Organofosforados, que são substâncias de composto químico orgânico, comumente utilizadas em atividades de controle de pragas nas lavouras, como nos agrotóxicos.[30].
Cinética
A cinética enzimática determina as velocidades de transformação dos reagentes em produtos, as quais possui interferência cinética por fatores como o meio reacional e fatores termodinâmicos. [37] As duas propriedades cinéticas mais importantes de uma enzima são: o tempo, que demora a saturar-se com um substrato em particular e o seu ponto máximo de saturação.
O fator que afeta a velocidade cinética da enzima é a concentração do Substratos [S]. Porém, estudar os efeitos dO [S] é complicado pois, o mesmo se altera no curso de uma reação. Todavia, é mais fácil mensurar a velocidade inicial V0 quando a concentração do substrato é muito maior que a concentração de enzimas [E][38].
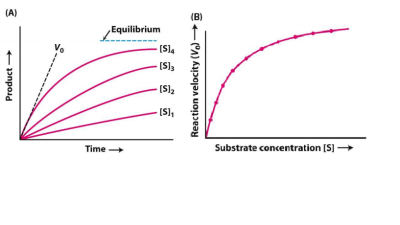
Equação de Michaelis-Menten
A chave para o entendimento do comportamento cinético de uma enzima, se baseia na concentração do complexo enzima + substrato [ES]
E + S ↔ ES ↔ E + P
E = Enzima
S = Substrato
K1 = Velocidade de formação do complexo enzima-substrato
K-1 = Velocidade de
K2 = Velocidade de Dissociação do complexo enzima-substrato
P = Produto
Como a concentração do Substrato é muito maior que a quantidade de enzimas, ocorre um deslocamento do equilíbrio para a direita para a formação do complexo Enzima-Substrato. Porém, quando esse complexo se forma ele também se desassocia para formar o complexo Enzima-Produto livre, aumentando a concentração do produto. Como a [S] » [E], a velocidade de formação e dissociação do complexo Enzima-Subtrato começa a ficar constante e, a partir desse ponto, é possível saber a velocidade de uma enzima com base na equação de Michaelis-Menten.[40]
Quando começamos a medição chamamos o estado [Enzima + Substrato] de estado pré estacionário (a enzima não se complexa com o substrato).Como a velocidade de de formação fica igual a velocidade de dissociação do complexo [Enzima-Substrato], chamamos esse estado de equilíbrio constante do estado estacionário,como a equação de Michaelis-menten se baseia nesse complexo [ES] essa cinética é chamada de Cinética do estado estacionário [40].
A equação de Michaelis-Menten é:
V0 = Vmax [S] / Km + [S] , aonde Km = K2 + (K-1)/K1
Isso mostra que conforme maior [S] maior é V0, e quanto menor o Km mais rápido é a V0.
A equação de Michaelis-menten assume que, a atividade enzimática ocorre em 2 etapas : E+s formando ES e ES formando E+P, mas, muitas enzimas possuem mais que 2 etapas, e isso faz com que a Vmax e o Km possam diferir muito de uma enzima para outra. Para tanto, se utiliza a velocidade de catálise (Kcat) que pode ser aplicada para determinar a velocidade de uma enzima na saturação, pois, é a constante que define o número de ciclos catalíticos realizados pelo sítio ativo, num dado tempo dividido por esse intervalo de tempo. Desta forma, a equação fica da seguinte maneira:
V0 = Kcat [Et] [S] / Km + [S]
Quanto maior o Kcat, maior é a velocidade inicial de uma enzima. Isso leva ao conhecimento da constante de especificidade, K = Km/Kcat, que é uma medida da eficiência de conversão pela enzima do substrato em produto. A enzima é específica para um substrato qualquer, quando ambos possuem forte tendência a interagir entre si, o que faz com que a reação ocorra rapidamente, devido à afinidade. Portanto, quando há tal especifidade há um baixo valor de Km e Kcat elevado. Essa premissa, portanto ,faz com que haja a associação de um alto Kcat com alta especificidade. A equação inversa, Kcat/Km, indica a eficiência catalítica de uma enzima e indica se o fator limitante em uma reação é a quantidade de substrato ou a velocidade de formação.[39]
A partir da Equação de Michaelis-Menten, foram criados métodos para obter a linearização do gráfico, que encontra a aproximação linear de uma função em um dado ponto, a fim de, obter uma reta que tem mais simplicidade para análise que de uma curva. [41]

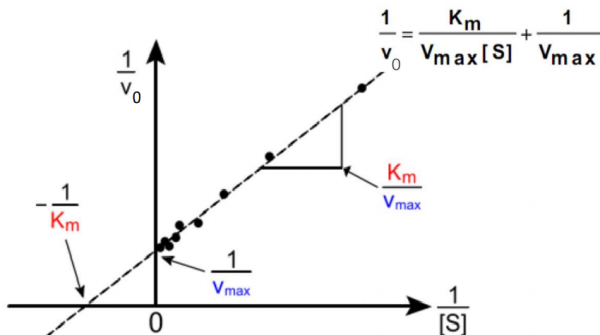
O diagrama de Lineweaver-Burke, por exemplo, é uma forma útil de visualização e cálculo dos valores de Km e Vmax. No vídeo abaixo do Stênio Foerster (Bacharel em Ciências Biológicas pela Universidade Federal Rural de Pernambuco), há a explicação de como obter a linearização usando a software excel[43]:
Duplo recíproco
Na equação de Michaelis-Mente, a mensuração de Vmax é complicada, devido às altas concentrações de substrato, dessa forma, criou-se o diagrama do duplo reciproco, que é uma derivação da equação de Michaelies-Menten. Esse diagrama permite determinar a Vmax e o Km com poucas medidas e a também achar a Vmax com concentrações baixas de substrato, dato pela equação de Lineweaver-Burk[44]:
1 / V0 = Km / Vmax[S] + 1 / Vmax
Duplo Substrato
Muitas enzimas do nosso organismo utilizam mais que um substrato para catalisar uma reação (por exemplo, as reações enzimáticas que acoplam o ATP). Existem dois tipos de reação de Duplo Substrato:
1 - Envolvimento complexo ternário.
Quando uma enzima E catalisa dois substratos diferentes S1 e S2, mas para que exista a formação de produto ambos os substratos devem estar ligados com a enzima, formando um complexo ternário ES1S2, essa formação pode ser aleatória já que a enzima pode se ligar primeiro ao substrato 1 e depois ao substrato 2 , ou vice-e-versa. Entretanto existem enzimas que tem essa formação ordenada, usando primeiro um substrato e depois outro, para então ter a formação de produto.
Para mensurar a velocidade de catálise do substrato 1 por esta enzima, varia-se a concentração do substrato totais. Então nesse primeiro ponto onde há concentração do substrato do estágio, nós temos uma Vmax e um Km específico, se aumentarmos a concentração do substrato 2 a velocidade máxima de catálise do substrato um vai aumentar, porém o km vai diminuir. enquanto mais se aumenta maior a velocidade de catálise substrato um ponto em que a velocidade de catálise do substrato 1 aumenta quando nós aumentamos a concentração do substrato 2. Para ocorrer a catálise do substrato 1 nós não precisamos do complexo enzima substrato 1 e 2, então se nós temos um ponto específico na concentração do substrato e aumentarmos a concentração do substrato 2, nós iremos também aumentar a formação do complexo ternário. Aumentando essa formação aumenta-se a Vmax de catálise do substrato 1, e dessa maneira, é necessário muito menos de substrato 1.
2- Não envolvendo complexo ternário.
trata-se de reações enzimáticas que não envolvem a formação de um complexo ternário, ou seja, aquele complexo enzima de substrato 1 e 2 não se formam, mas, a enzima catalisa dois substratos diferentes. Uma reação enzimática nesta condição é uma reação pingue-pongue ou duplo deslocamento.
Bioenergia
No setor bioenergético a capacidade das enzimas em atuar como catalisador biológico de forma eficaz e veloz, faz com que as enzimas desempenhem importante papel para a obtenção de energia limpa. Atualmente, a busca comercial (acerca das energias sustentáveis) acabaram por fornecer condições de pesquisa e desenvolvimento favoráveis ao entendimento de como a dinâmica das enzimas influencia de forma positiva ou negativa nas reações enzimáticas, que são parte do processo para obtenção da bioenergia[46].
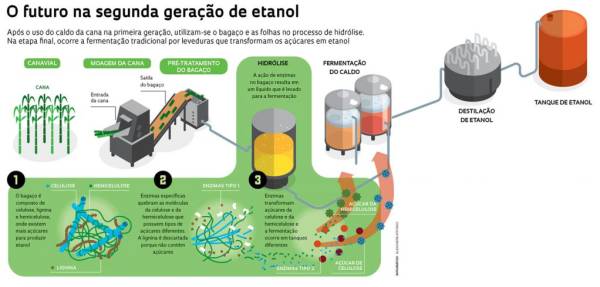
Na produção do Bioetanol de segunda geração, por exemplo, que conta com matérias primas de alto teor energético, as enzimas são responsáveis pela reação que terá como produto açúcares fermentáveis [47]. Para este caso, enzimas que são produzidas principalmente através de fungos, como é o caso das celulases, interatuam em conjunto com uma fração lignocelulósica (possui lignina e celulose em sua estrutura química) do extrato, e, liberando-se assim, os já citados açúcares, fermentáveis, que serão utilizados posteriormente como matéria prima de outra reação química que finamente trará como produto o etanol e o CO2 [48].
Pesquisadores brasileiros do Centro de Tecnologia Canavieira, em parceria com a Embrapa Agroenergia do Distrito Federal, desenvolveram um meio para se obter etanol com bagaço e palha da cana-de-açúcar para melhorar a indústria de etanol de segunda geração (E2G): um coquetel de enzimas denominado CMX, que é uma mistura enzimática obtida de três microrganismos que tem alto rendimento para desconstruir a biomassa da cana-de-açúcar[50].
Esse coquetel não só poderia impulsionar o mercado de etanol no brasil, fazendo com que uma usina com produção anual de 70 mil toneladas fosse capaz de ter ganhos de R$50 milhões, mas também, tornaria possível uma grande expansão de outros setores da indústria como o de rações e têxtil[50].
Seguindo essa lógica demonstrada pelo exemplo acima, a principal aplicação das enzimas na bioenergia se dá pela eficácia e velocidade com que transforma Biomassa em Bioenergia, através da hidrólise (e posteriormente fermentação) [51][52].
Mas antes que a hidrólise aconteça, o material orgânico (cana-de-açúcar) é submetido à um processo chamado pré-tratamento, que consiste em desestruturar o material lignocelulósico, fazendo com que as fibras de celulose e hemicelulose fiquem mais expostas às enzimas na hidrólise. Isso é feito deixando o material em contato com ozônio, que é oxidante. Com essa etapa realizada, a lignina é removida devido às diferenças eletrônicas entre lignina e carboidratos e a baixa remoção das hemoceluloses, aumentando a digestão das enzimas posteriormente.
Após o pré-tratamento, as enzimas são usadas para hidrolisar as fibras em açucares fermentáveis, que serão usadas pelas leveduras na próxima etapa (fermentação e produção do etanol). Embora a hidrólise enzimática, demande menor gasto energético e alta especificidade pelo substrato -fazendo com que a produção de compostos tóxicos ou indesejáveis seja evitada-, ela é mais lenta e muitas vezes tem um gasto que torna seu custo-benefício ruim quando comparado à hidrólise química. Uma alternativa para solucionar esse problema, seria produzir as enzimas utilizadas na hidrólise enzimática através de rejeitos sólidos agroindustriais, diminuindo não só o custo, mas também os danos ao meio ambiente.
A busca recente por sustentabilidade e energia limpa, também criou a necessidade de se desenvolverem combustíveis com características físico-químicas próximas das características atuais (como exemplo, os “DROP-IN”), com o objetivo de se lançar mão da infraestrutura já existente. Nesse sentido, o grande problema dos DROP-IN está está na presença de intermediadores oxigenados, onde o oxigênio presente na estrutura do biocombustível tem relevante capacidade em danificar motores e peças dos veículos, por exemplo. Os processos de descarboxilação são negativos pelos gastos tidos nesses processos, além de gerarem subprodutos não desejáveis. Assim, as enzimas aparecem novamente na bioenergia, mas de forma diferente, uma vez que, estudos recentes comprovam que algumas famílias de enzimas apresentam propriedade única de remover o oxigênio presente nas grandes cadeias de ácidos graxos. O estudo intitulado “Enzymes make light work of hydrocarbon production” divulgado na revista Science, já aponta que algumas enzimas que pertencem a família 152 e a superclasse P450 possuem essa propriedade [53].
Outra propriedade importante, que justifica o uso das enzimas nos processos bioenergéticos, é a sua originalidade, ou seja, para cada característica da reação a ser feita existe um tipo específico de enzima a ser utilizada, de forma que, o processo em geral tenha um melhor rendimento, além de ser biodegradável e resistente a condições extremas de temperatura e pressão, mantendo sua aplicação alinhada com a narrativa da sustentabilidade[50].
Existem muitos projetos de pesquisas científicas que identificam enzimas aptas para a produção da bioenergia, isto é, aquelas que são capazes de degradar a biomassa para que assim se otimizem os processos de produção desse novo modelo energético. Uma das pesquisas, com participação: da Universidade de York, FAPESP e do conselho do Reino Unido, busca alternativas para substituição do combustível a base de petróleo, buscando como ideia central de projeto, encontrar diferentes enzimas para a produção dos biocombustíveis e energia elétrica[54].
Quando se conhece as enzimas usadas no trabalho, o trabalho acaba se tornando mais fácil, logo, é de extrema importância compreender o funcionamento das mesmas, e assim as suas respectivas potencialidades. Portanto, os pesquisadores buscam novas formas de “marcar” enzimas extracelulares, com novas tecnologias de afinidade proteica, que não atravessam membranas biológicas mas, que consiga “marcar” essas proteínas extracelulares. Assim, com essas enzimas “marcadas”, pode-se dizer que essas estão “purificadas”, ou seja suas concentrações vão ser enriquecidas na parte que será extraída como da Biomassa e a cultura microbiana, sequenciando assim pequenos pedaços das proteínas desejadas ( Como no caso do bioetanol, a lignocelulose). Por fim, já com essas informações, pode-se realizar uma análise secretômica. Dessa forma, os pesquisadores tem mais informações sobre as enzimas, e assim, não é necessário analisar grandes cadeias sequenciadas. em que 95 % das informações serão inúteis. Com esse método é possível identificar as enzimas que são secretadas durante os processos de hidrólise (conforme explicado anteriormente). Portanto, com o desenvolvimento de pesquisas com essas funcionalidades, irão contribuir muito com as biorrefinarias, e no seu crescimento para substituição de derivados do petróleo. Assim, consideramos que o fator que mais dificulta o pleno aproveitamento das capacidades de enzimas são os próprio procedimento comumente aplicado, visto que apenas 5% delas interessam de fato para essa área, assim vemos a extrema importância da busca por novas tecnologias com pesquisas cientificas [55].
Nomenclatura e Classificação EC
A nomenclatura das enzimas pode ser feita de três diferentes maneiras.[56] Sendo elas :
1. Nome usual: Compreende as enzimas com utilização mais recorrente e consagradas pelo uso, como a Pepsina, Tripsina e a Ptialina[56].
2. Nome Recomendado: Para efeitos técnicos e profissionais, usam-se os Nomes Recomendados, nos quais são adicionados ao nome do substrato a qual a enzima atua, o sufixo “ase”. Um exemplo de Enzima com Nome Recomendado é a Urease, que catalisa a reação de hidrólise da ureia em Amônia (NH4) e gás carbônico (CO2)[56].
3. Nome Sistemático: Para publicações científicas e pesquisas mais aprofundadas, o ideal é que se utilizem nomeações que especifiquem exatamente qual enzima está sendo tratada e, suas funcionalidades, para isso, é utilizado seu Nome Sistemático. Instituído pela União Internacional de Bioquímica e Biologia Molecular (IUBMB), o Nome Sistemático das enzimas, carrega consigo, preciosas informações das mesmas, para isso, normalmente este nome é divido em três partes: o nome do substrato, o tipo de reação catalizada e o sufixo -ase. Além do Nome Sistemático, as enzimas também recebem numerações, chamadas de Números EC (Enzyme Commission Numbers). Este sistema de numeração permite relacionar cada enzima de com sua reações químicas de catalisação. Também convencionado pela IUBMB, a numeração de uma enzima é feita pela sigla EC (Enzyme Commission) seguida de quatro números, que a identificam[56].
A seguir, estão apresentadas as Classes, subclasses, grupos de atuações e funções[56][57]:
1) Oxido-redutases (catalisam as reações de oxidação-redução ou transferência de elétrons – Desidrogenases e Oxidases). [56]
- 1.1.atuando em CH-OH
- 1.2.atuando em C=O
- 1.3.atuando em C=O-
- 1.4.atuando em CH-NH2
- 1.5.atuando em CH-NH-
- 1.6.atuando em NADH, NADPH
2) Transferases (reações de transferência de grupos funcionais como amina, fosfato, acil, carboxil, transferem do grupo doador para um receptor). [56]
- 2.1.grupos com um carbono
- 2.2.grupos aldeído ou cetona
- 2.3.grupos acil
- 2.4.grupos glicosil
- 2.7.grupos fosfatos
- 2.8.grupos contendo enxofre
3) Hidrolases (reações de hidrólise de ligação covalente, onde ocorre a quebra de uma molécula em moléculas menores com a água). [56]
- 3.1.ésteres
- 3.2.ligações glicosídicas
- 3.4.ligações peptídicas
- 3.5.outras ligações C-N
- 3.6.anidridos ácidos
4) Liases (adição de grupos a duplas ligações ou remoção de grupos deixando dupla ligação, clivagem de ligações em a ação da água). [56]
- 4.1. =C=C=
- 4.2. =C=O
- 4.3. =C=N-
5) Isomerases (reações de interconversão entre isômeros ópticos ou geométricos - Epimerases). [56]
- 5.1.racemases
6) Ligases (condensação de duas moléculas, sempre às custas de energia, geralmente do ATP - Sintetases). [56]
- 6.1. C-O
- 6.2. C-S
- 6.3. C-N
- 6.4. C-C
Ver Também
Ligações Externas
1. * https://www.biologianet.com/biologia-celular/enzimas.htm - Enzimas - Acesso em: 12 jun. 2020
2. * https://pt.khanacademy.org/science/biology/energy-and-enzymes/introduction-to-enzymes/a/enzymes-and-the-active-site - Enzimas e Sítio Ativo - Acesso em: 20 jun. 2020
Notas
Referências
1. PEREIRA, A.; ENUMO, D.; CHESCO, N. Estudo da Termodinâmica da Produção de Enzimas e Aplicações na Indústrias Alimentícia. Evento de Iniciação Científica, 2015 https://portaldeperiodicos.unibrasil.com.br/index.php/anaisevinci/article/view/209/199
2. BORGES, Júlio César. Enzimas. https://edisciplinas.usp.br/pluginfile.php/3173462/mod_resource/content/1/Aula06BioqAvan_Enzimas.pdf. Acesso em: 20 jun. 2020
3. Worthington, C.; Worthington, V. (2019). «Iintroduction to Enzymes». Worthington Biochemical Corporation http://www.worthington-biochem.com/introbiochem/Enzymes.pdf. Acesso em: 23 jun. 2020
4. ENZIMAS. Portal São Francisco. https://www.portalsaofrancisco.com.br/biologia/enzimas#:~:text=Enzimas%20s%C3%A3o%20subst%C3%A2ncias%20prot%C3%A9icas%20produzidas,que%20sofrem%20a%20sua%20a%C3%A7%C3%A3o.. Acesso em: 25 jun. 2020
5. INTRODUÇÃO AO ESTUDO DAS ENZIMAS. Portal Cesad: Universidade Federal de Sergipe. https://www.cesadufs.com.br/ORBI/public/uploadCatalago/11283616022012Bioquimica_aula_10.pdf. Acesso em: 23 jun. 2020
6. PINTO, Gerson Ferreira; MENEZES, Reginaldo Ramos de. Cinética enzimática. Rio de Janeiro: E-papers, 2009. Disponível em: https://books.google.com.br/books?id=qLq2XI5ap6AC&printsec=frontcover&hl=pt-BR#v=onepage&q&f=false. Acesso em: 23 jun. 2020.
7. COELHO, Maria Alice Zarur. Cinética em fase homogênea. Rio de Janeiro: Eqb4383 – Enzimologia Industrial, -. Color. Disponível em: http://www.eq.ufrj.br/biose/nukleo/aulas/Enzimol%20Grad/EQB483_aula2.pdf. Acesso em: 23 jun. 2020.
8. HOTTA, Carlos. Cinética enzimática. -: Qbq0230n – Bioquímica, 2018. Color. Disponível em: https://edisciplinas.usp.br/pluginfile.php/4438868/mod_resource/content/1/0830_cinetica_enzimatica.pdf. Acesso em: 23 jun. 2020.
9. NEVES, Valdir. Experimentos de Bioquímicas. Araraquara. Universidade Estadual Paulista Julio de Mesquita Filho. Disponível em : http://www.fcfar.unesp.br/alimentos/bioquimica/enzimas.htm. Acesso em: 23 jun. 2020.
10. MAGALHAES, Lana. Enzimas: o que são, exemplos e classificação. Disponível em: https://www.todamateria.com.br/enzimas/. Acesso em: 23 jun. 2020.
11. Castro, Nivalde José de, e-mail: nivalde@ie.ufrj.br, e Dantas, Guilherme de Azevedo, e-mail: guilhermecrvg@yahoo.com.br. Bioenergia no Brasil e na Europa: uma análise comparativa; Bioenergia no Brasil e na Europa: uma análise comparativa. Brasil: N. p., 2008. Web.
12. SILVA, Jéssica Caroline De Araújo. Importância das enzimas produzidas por microrganismos para a obtenção de bioetanol: Tecnologia permitirá marcação mais exata de enzimas extracelulares. Instituto de Microbiologia Paulo de Goés. Disponível em: http://www.microbiologia.ufrj.br/portal/index.php/pt/destaques/novidades-sobre-a-micro/317-importancia-das-enzimas-produzidas-por-microrganismos-para-a-obtencao-de-bioetanol. Acesso em: 20 jun. 2020.
13. NELSON, David L.;COX, Michael M. Lehnigner: Principios de Bioquimica. 5ºEd. São Paulo: SARVIER. 2011
14. P. A. CASCIATORI , F. P. CASCIATORI , J. C. THOMÉO e R. da SILVA HIDRÓLISE DE BAGAÇO DE CANA PRÉ-TRATADO EMPREGANDO COQUETÉIS CELULOLÍTICOS FÚNGICOS. Encontro Brasileiro sobre o Ensino de Engenharia Química, 2016 Disponível em: <https://proceedings.science/cobeq/cobeq-2016/papers/hidrolise-de-bagaco-de-cana-pre-tratado-empregando-coqueteis-celuloliticos-fungicos→. Acesso em: 20 de jun. de 2020
15. Acessoria de Comunicação IFSC. Projeto identifica enzimas aptas para produzir bioenergia , email : rsintra@gmail.com. Disponível em : http://www.usp.br/agen/?p=81121 < Acesso em: 23 de jun. de 2020
16. WORTHINGTON, Charles. Worthington Biochemical Corporation. (2015). Specificity of enzymes. Em Introduction to enzymes. Disponível em http://www.worthington-biochem.com/introbiochem/specificity.html. Acesso em: 25 de jun. de 2020.
17. NOMENCLATURA E CLASSIFIÇÃO DAS ENZIMAS. Portal:wp.ufpel.edu.br › aquitembioquimica › files › 2018/06. Acesso em: 23 de jun de 2020.